来源:生物制药小编 癌症免疫治疗在近些年来被认为是一项重大的科学突破,而抗体治疗是这一突破的核心。在过去的几十年里,超过80种不同的基于抗体的分子在中国、欧盟、美国和日本等被批准用于人类疾病治疗。目前,在I期、II期和III期临床试验中有接近上千种抗体,涵盖了人体内的各种疾病。然而,大多数控制细胞生长、增殖和死亡的肿瘤特异性抗原都在细胞内。传统抗体治疗的一个局限性是抗体只能针对细胞表面抗原或可溶性抗原,而对细胞内抗原没有效果。 2009年由美国NCI(National Cancer Institute),弗雷德·哈钦森癌症研究所以及基因泰克等机构研究人员在Clin Cancer Res.联合发表了一篇题为“The Prioritization of Cancer Antigens: A National Cancer Institute Pilot Project for the Acceleration of Translational”的研究。该研究对“理想的”癌症抗原进行了罗列以及综合评分。其中在排名前20的理想肿瘤抗原中胞内蛋白占据一半以上,可见胞内蛋白作为肿瘤靶点具有极大的潜力(图1)。为了针对这些胞内抗原,目前已经开发了一组特殊的新型抗体,称为T细胞受体(TCR)样抗体,用于临床治疗。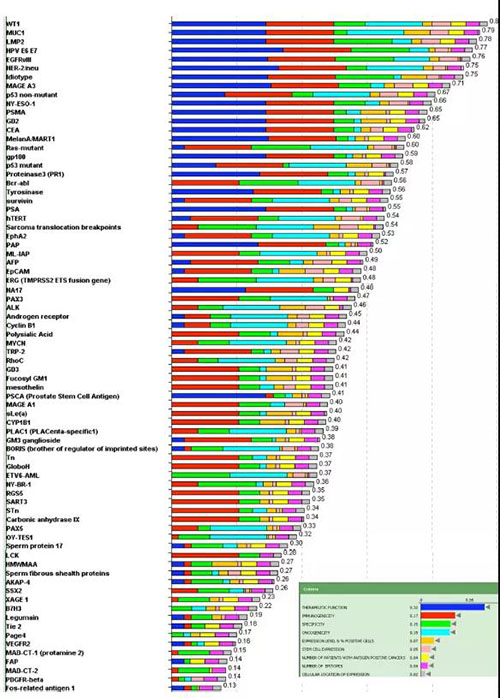
图1. 理想癌症抗原的优先排序 细胞内的肿瘤特异性抗原可以通过主要组织相容性复合体(MHC)I类信号通路,以肿瘤特异性肽/MHC复合物的形式存在于肿瘤表面上。TCR样抗体识别肿瘤细胞表面的肽/MHC复合物的方式与我们熟知的TCR-T原理相同(图2)。
图2. T细胞受体(TCR)和TCR样抗体示意图 TCR样抗体的作用主要集中在检测肿瘤细胞表面肿瘤特异性多肽/MHC复合物的表达和介导对肿瘤细胞的杀伤作用两个方面。其详细分子机制概述如下(图3):
1. TCR样抗体可以与荧光试剂偶联,检测肿瘤细胞表面多肽/MHC复合物的表达水平。例如,TCR样抗体已经与荧光试剂偶联,以检测Wilms Tumor 1(WT1) RMFPNAPYL肽/人类白细胞抗原(HLA-A2)复合物在白血病细胞表面的表达水平,这提供了肿瘤特异性抗原的清晰图谱。
2. TCR样抗体与多肽/MHC复合物结合后可直接诱导肿瘤细胞死亡。这一作用是通过激活JNKs和固有的caspase通路,伴随着肿瘤细胞中线粒体细胞色素c和凋亡诱导因子的释放而介导的。
3. TCR样抗体可以转化为CAR结构,通过T细胞介导特异性的肿瘤溶解。由于肿瘤细胞表面缺乏肿瘤特异性生物标志物,传统的CAR-T治疗实体瘤收效甚微。预见TCR样抗体的CAR-T细胞治疗可能对实体瘤有特殊的价值,因为它针对的是细胞内的肿瘤特异性抗原。
4. TCR样抗体可通过ADCC、CDC或ADCP作为针对肿瘤细胞的标准抗体疗法。
5. TCR类抗体还可以与细胞毒性有机化合物 (如 ADC、放射性核素和蛋白质毒素) 偶联,以介导对肿瘤细胞的特异性杀伤。
图3. TCR样抗体的抗肿瘤分子机制 TCR样抗体最大的优点是能够以最小的体外操作来靶向细胞内的肿瘤抗原。TCR-T过继细胞疗法也可以针对细胞内抗原,但需要更复杂的准备过程,而且技术要求高、费用高、耗时长。然而,TCR类抗体相对容易制备和储存,大大降低了临床成本。因此,在最近些年里,TCR样抗体在肿瘤治疗领域的研究取得了突飞猛进的进展。目前有40多种TCR样抗体处于临床前开发阶段,它们中的大多数在体外和体内都显示出很强的抗肿瘤作用(图4)。
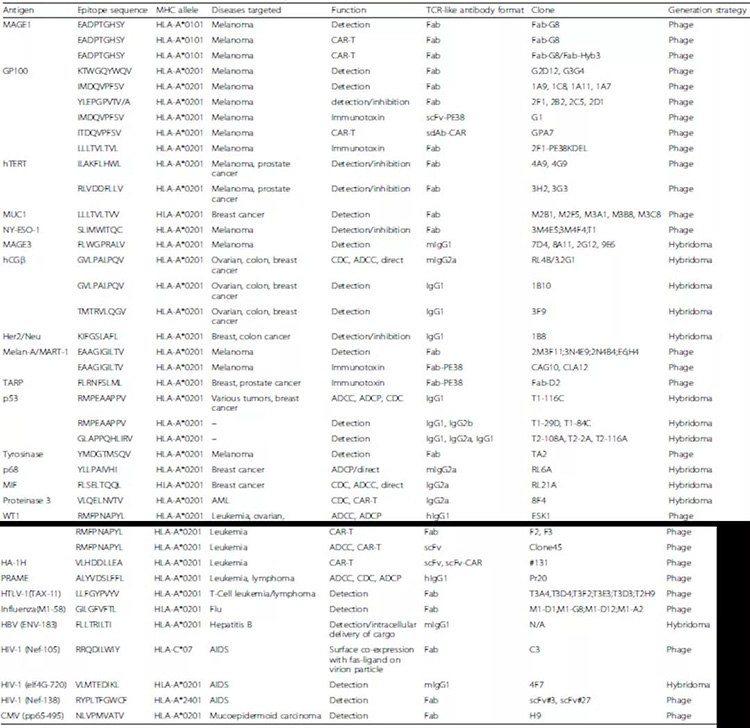
图4. 目前在研的TCR样抗体 然而,要获得TCR样抗体的临床成功,还必须克服几个障碍。首先,TCR样抗体是MHC限制性的,这意味着它们只对在特定MHC等位基因上表达肿瘤特异性抗原的特定患者有效。由于HLA-A2是癌症患者最常见的MHC等位基因,已发现许多与该等位基因相关的肿瘤特异性多肽。然而,其他HLA等位基因仍然缺乏肿瘤特异性多肽,这阻碍了TCR样抗体治疗的发展。进一步鉴定不太常见的MHC相关肽将有助于解决这个问题。第二,肿瘤细胞表面肽/MHC复合物的下调或缺失是肿瘤细胞逃避免疫监视的常见机制。然而,一些报告显示一些化学物质、细胞因子或放射治疗可以上调MHC的表达并激活MHC信号通路。因此,TCR样抗体可以与其他疗法联合使用以达到最佳效果。第三,免疫抑制环境是TCR样抗体免疫治疗的障碍。肿瘤细胞驻留在隐蔽的位置,以阻止T细胞的进入,并产生低氧环境以及分泌大量免疫抑制细胞因子,如IL-10、TGF-β。此外,肿瘤细胞周围有许多抑制性免疫细胞,这都会削弱抗肿瘤免疫反应。因此,TCR样抗体可能与肿瘤细胞表面的肽/MHC复合物结合,但可能不介导肿瘤的破坏。将TCR样抗体治疗与其他免疫抑制疗法相结合,或许可以帮助解决这一问题。
总之,TCR样抗体作为癌症免疫治疗领域的新工具,刚刚开始引起科学界的关注。TCR样抗体将识别肿瘤多肽/MHC复合物的良好特异性与抗体的生物学和药理学特性相结合, 其可能是肿瘤免疫治疗的下一代疗法,并在临床上具有广阔的应用前景。 如涉及知识产权请与我司联系
参考文献
1. Qinghua He, et al., TCR-like antibodies in cancer Immunotherapy, Journal of Hematology & Oncology,2019.
2. Martin A. Cheever, et al., The Prioritization of Cancer Antigens: A National Cancer Institute Pilot Project for the Acceleration of Translational Research,Clin Cancer Res,2009.
3. Yixiang Xu, et al., T-cell receptor mimic (TCRm) antibody therapeutics against intracellular proteins, Antibody Therapeutics, 2019.
|