来源:闲谈 Immunology 在进行生物信息学评估之后,通常会通过全面产品表征,对潜在候选分子进行实验评估。 与mAb成药性评估高度相关的质量属性,汇总在下表中。 通常,用于可开发性评估的样本,是通过瞬时转染(例如HEK293细胞)产生的。可以评估与表达宿主无关的特性,例如一级序列,疏水性,溶解性,热稳定性和抗原结合亲和力。 因为PTM高度依赖于细胞系和细胞培养条件,因此通过可开发性评估,候选分子进入工艺开发阶段,通常换成CHO等细胞,稳定表达,进行工艺优化。 1. 一级结构确认和序列变异体 预期氨基酸序列的构象是进一步分析和开发mAb先导候选分子的先决条件。现代质谱(MS)具有以≤2Da的精度准确测量IgG的分子量(约150kDa)的能力。可以通过液质联用(LC-MS)和MS/MS肽图确认完整的一级序列。 多项研究表明存在低丰度序列变异体,通过使用LCMS/MS与数据库搜索相结合,可以检测和鉴定低水平的序列变异体;存在极低丰度序列变异体的原因:可能是自然发生的转录和翻译过程中的低频错误。 通过产品表征,可以选择具有最小序列变异的mAb候选分子和克隆。 2. 翻译后修饰 LC-MS具有很高的灵敏度,快速的周转时间,最重要的是能够获得深入序列及修饰信息,因此在可开发性评估中起着至关重要的作用。可从LC-MS完整分析,从亚基或肽水平获得PTM信息。 LC-MS分析能够检测各类修饰,例如糖型,N末端pyroGlu,C末端Lys,C末端酰胺化和糖基化。在亚基水平或还原成轻链和重链后的LC-MS分析将修饰定位于Fab,F(ab′)2,Fc区,轻链或重链。 除了传统上使用的木瓜蛋白酶,使用有限的Lys-C或Ides酶消化可以实现更特异性的消化。IdeS消化和还原的结合,将每个片段的分子量降低到23-25 kDa,从而可以测量单同位素分子量。最终,在肽水平上的分析,可以精确定位完整和亚基水平的修饰位点。更重要的是,在肽水平上的分析,可以检测到在完整和亚基水平上无法检测到的修饰,例如Asn脱酰胺,分子量差异约为1 Da。由于色谱分离,没有分子量差异的修饰,例如Asp异构化,从L-Cys到D-Cys和Ser外消旋化,也可以通过LC-MS检测。 基于安全性和功效考虑修饰 修饰与安全性和功效问题有关。包括脱酰胺,异构化,Met和Trp氧化,未配对的半胱氨酸和可变域中的其他糖基化。在扩展的表征和强制降解研究期间,应仔细检查这些修饰。 寡糖有三种类型,α1,3-Gal,NGNA和高甘露糖,应仔细评估。如前所述,α1,3-Gal和NGNA具有免疫原性。由于缺乏核心岩藻糖,高甘露糖已被证明可导致较短的体内半衰期并增强抗体依赖性细胞介导的细胞毒性(ADCC)。 此外,由于岩藻糖基化水平与增强的ADCC相关,因此必须对其进行监测,这取决于mAb的作用机理(MOA),可能是有益的或有害的。对于需要抗体依赖细胞杀伤靶细胞,则是有益的,但对于阻断性抗体,则是有害的。 与降解相关的修饰 尚未报道这组修饰会影响产品的安全性或功效,但可能会引起免疫原性(因为这些修饰在人类内源性IgG或降解产物中均不存在),这组修饰包括部分前导序列,三硫键,硫醚和糖基化。为了最大程度地降低这种风险,应选择这些修饰类型中含量最低的单克隆抗体候选物。此类别中的修饰也可能高度依赖于细胞系和细胞培养参数,例如温度,pH,培养基组成和配方。 引起异质性的修饰 N末端pyroGlu的形成和C末端Lys的部分去除是引起异质性的两个特征修饰,但对安全性或功效没有影响。另外,这些修饰的水平高度依赖于细胞系和细胞培养条件。 与Fc的糖基化相关的末端Gal的水平也由于其对过程变化的敏感性而值得注意。末端Gal对结构,稳定性或清除没有影响。最近的研究表明,末端半乳糖可能对ADCC的影响最小,但对CDC((complement dependent cytotoxicity test) 补体依赖的细胞毒性试验)的影响却很大。因此,对于涉及CDC的MOA的mAb候选分子,应考虑末端半乳糖的水平。由于末端半乳糖基化的水平随细胞系和细胞培养条件的不同而变化,因此在开发过程的后期可能需要重新评估。 3. FcRn亲和力 FcRn结合是影响mAb半衰期的最关键因素之一。通常通过Biacore测量mAb候选物的FcRn结合亲和力,已开始使用生物层干涉术(BLI)或FcRn亲和色谱的新替代方法。与Biacore和亲和色谱相比,使用BLI可获得更高的通量。通常,在酸性pH下具有更强FcRn结合,但在中性pH下具有快速解离的mAb,显示出更长的体内半衰期。 4. 热稳定性 热稳定性是蛋白质在不同温度环境下维持其结构和功能完整性的能力,并且是mAb的固有特性,可在制造和存储过程中影响产品的稳定性,例如聚集。mAb候选物的高热稳定性表明结构良好,需要更多的能量才能展开。因此,mAb的较高热稳定性通常与较低的部分展开和聚集趋势相关。除了聚集以外,还显示出热稳定性较低的单克隆抗体的表达也较低。 通常通过差示扫描量热法(DSC)来测量热稳定性。使用差示扫描荧光法(DSF)可以对96或384个样品进行高通量热稳定性筛选。可以基于获得的热力学参数(例如,展开的中点温度(Tm)或展开温度的起始时间(Tonset))对在相同条件下分析的多个候选对象进行排名。 5.溶解度 溶解度是mAb的重要可开发性参数,尤其是考虑到更高浓度制剂(100 mg / mL及更高浓度)发展的趋势。单克隆抗体在整个加工,储存和给药过程中必须保持可溶。低溶解度会导致纯化,无菌过滤,填充和精加工,运输,储存过程中出现问题,更重要的是,会影响活性,生物利用度和免疫原性。从方法来看,对于所有色谱步骤,在用于生物处理的缓冲液中的最小溶解度(例如20-30mg/mL)是必需的。在最终的超滤/渗滤(UF/DF)步骤中,将单克隆抗体以高于目标药物产品的浓度缓冲液交换到制剂缓冲液中,因此需要更高的溶解度。 单抗较低的溶解度通常是由于与暴露的疏水或带电斑块的强烈自缔合引起的。单克隆抗体的二价性质放大了它们的自缔合趋势。由构象变化或化学修饰引起的胶体不稳定性也会导致mAb的溶解性差。此外,mAb的溶解度通常受溶液性质的影响,例如缓冲液的组成,离子强度,pH和温度。 根据氨基酸序列预测mAb候选物的溶解度具有挑战性,因此应通过实验研究mAb的溶解度。但是,研究mAb的溶解度直接需要大量的蛋白质,通常为数百毫克,因此通常不生产如此大量的所有候选物用于溶解度研究。由于可用于开发性评估研究的样本数量有限,因此通常使用间接测量方法。例如,向mAb溶液中添加聚乙二醇(PEG)会导致浓度低得多的沉淀,因此可通过外推至PEG浓度为零来确定mAb的表观溶解度。可以以高通量方式为mAb候选者选择实现此方法。但是,PEG诱导的沉淀可能无法真正反映mAbs溶解度差的机理,因此应考虑采用正交方法或直接评估高浓度下的溶解度以确认预测的溶解度或验证等级顺序。 还可以通过测量渗透第二维里系数B22(与分子间相互作用相关的热力学参数)来预测使用低浓度样品的mAb的高浓度行为。正和负B22值分别表示排斥力或吸引力。影响B22的参数包括静电相互作用,范德华力,排除体积,水合力和疏水作用。在许多获得B22值的方法中,例如自相互作用色谱(SIC),膜渗透压(MO)和分析超离心(AUC), 最常见的方法是通过静态光散射(SLS)。最近,该值被用于确定通用溶解度线,即“液相线”,作为mAb相图的一部分。 交叉相互作用色谱法(CIC)分析,由Jacob等人介绍。充分利用了色谱柱上的累积效应来捕获测试mAb与大量(30mg)固定化人血清IgG之间的弱结合。由于暴露的粘性表面(疏水性或电荷性),CIC分析中洗脱较晚的单克隆抗体与溶解性差相关。另一个值得一提的方法是自相互作用纳米粒子光谱学,它使用金纳米粒子将mAb分子浓缩到高的局部浓度,以放大弱的自相互作用。该方法也可用于单克隆抗体候选物的高通量筛选。 6. 粘度 通过皮下(SC)注射给药的高浓度药物产品需要具有可控粘度的制剂,这使其成为早期评估的另一个关键因素,从而缓解可开发性问题。高粘度可能对最终的UF/DF步骤和填充/精加工操作构成挑战。粘性药品会导致输送困难,导致患者依从性降低。粘性样品还可能对分析方法的开发和仪器提出采样挑战。 mAb的高粘度是由于通过静电或疏水相互作用或两者结合而产生的强烈的自缔合引起的。尽管可以探索许多配方参数,包括pH值,盐,糖以及各种小分子赋形剂和去污剂,用以降低粘度。但是选择最小内在问题,例如暴露于疏水性或带电斑块的mAb候选分子,是降低高粘度风险的最有效方法。 可以采用多种方法来测量粘度,包括Cannon-Fenske Routine粘度计,泰勒锥板法和各种流变仪。用于测量粘度的大多数常规技术需要大量材料。为了克服这一挑战,特别是在可开发性评估方面,已开发出一种高通量DLS方法,该方法基于对高浓度mAb溶液中表观聚苯乙烯珠半径的测量,以反算mAb溶液的粘度。此方法仅可用于不与微珠相互作用的mAb,否则无法可靠地测量表观微珠半径。从DLS测量得出的高通量扩散相互作用参数也已显示与粘度相关。近年来,允许使用≤100μL进行粘度测量并具有自动样品处理功能的仪器已在市场上出售,它们适用于在开发性评估过程中测量粘度。 由于粘度对工艺和产品开发十分重要,因此,为开发性评估定义粘度目标是非常重要。制剂粘度至少应足够低,以允许通过手动注射来递送药物制剂。粘度目标通常是根据每个公司的内部开发经验制定的,尤其是在开发带有预填充注射器和自动注射器装置的SC产品时。例如,建议将粘度分为三类:1)“首选”粘度为10 cP或更低;2)10至20 cP之间的“可接受”粘度;和3)“不可接受”的粘度> 20 cP。可以将其用作定义粘度目标的起点,同时还要考虑工艺研发和产品开发的内部经验以及输送设备(例如自动注射器)的产品知识。 7.聚集倾向 聚集体是最常观察到的与产品相关的杂质。由于其会导致免疫原性,所以需要进行密切监控。因此,它是可开发性评估的关键组成部分。除了使用预测工具外,还可以在扩展的表征和强制降解研究期间直接测量聚集倾向。尽管通常由于材料限制只能获得低浓度的数据,但重要的是评估中高浓度(50-100 mg / mL)范围内mAb的胶体稳定性和聚集倾向。 通常,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)或毛细管电泳(CE-SDS)用于在变性条件下还原或非还原下测定mAb单体,片段和共价聚集体。多种方法可用于在天然条件下测量mAb可溶性聚集体(二聚体,低聚物或亚可见颗粒)。体积排阻色谱法(SEC)是确定mAb的高分子量蛋白(例如二聚体,三聚体或低聚物)和低分子量蛋白的最常用方法。它可以在扩展表征和强制降解期间评估聚集体。值得一提的是,SEC有时可以揭示单体,聚集体和碎片百分比以外的其他属性。mAb的SEC异常行为(例如峰拖尾)可能表明其生物物理特性不理想。较长的保留时间和不对称峰形可能表明mAb与SEC色谱柱之间存在非特异性相互作用。研究表明,SEC甚至可以将含有琥珀酰亚胺中间体的mAb变异体与具有Asn脱酰胺基(17Da)或Asp异构化(18Da)的单克隆抗体分离。SEC还显示,包含氧化Trp的mAb变体早于主峰洗脱。这些示例表明,对SEC数据的解释应谨慎进行,因为早晚的峰可能并不总是代表高分子量蛋白或者低分子量蛋白。 对于大型聚集体,可以使用光散射来表征<1nm至1-10μm范围内的颗粒。DLS方法可用于确定mAb的流体动力学直径和相互作用参数(例如KD),这些参数可在高通量模式下以较低的样品消耗运行。也可以考虑使用测量浊度的方法(例如,可见波长处的光密度和浊度法)来检测亚微米/亚可见颗粒。这些技术可以针对高通量和低的体积消耗来开发,因此可以用于可开发性评估。可以使用光阻法(例如HIAC)和流动成像方法(例如微流成像(MFI)进行亚可见粒子表征和定量,以检测大于2μm的尺寸。目测方法用于检测可见范围内的蛋白质颗粒,通常>70至100μm。 除了直接测量聚集体的水平外,还可基于疏水性或蛋白质相互作用对聚集倾向进行排名,因为它们是聚集的主要驱动力。诸如1-苯胺基萘磺酸盐(ANS)和硫代黄素等荧光染料可用于以最少的样品需求以高通量方式探测暴露的疏水斑块。亲和捕获自相互作用纳米粒子光谱学(AC-SINS)可提供有关不同溶液条件下的相互作用和聚集倾向的粗粒度信息,可用于在可开发性评估中发挥作用。 8. 电荷变异体 mAb的电荷变化反映了各种PTM的总和。在整个开发过程中都需要密切监测mAb的变体,以确保一致的峰分布。由于电荷变化对工艺改变的过程非常敏感,因此当工艺发生变化时,电荷变化是证明可比性的具有挑战性的质量属性之一。 典型的mAb电荷变异体特征是通过基于电荷的方法(例如离子交换色谱法和等电聚焦)表征的,通常包含一个主峰以及几个较小的酸性和碱性峰。导致形成酸性或碱性物质的修饰如表5所示。值得一提的是,几种修饰可能会影响mAb变异体的色谱分离,从而彻底改变mAb结构。例如,具有较小寡糖的mAb有助于碱性物质的形成,而氧化的Met可能有助于酸性或碱性物质的形成。类似地,重链可变域中的不完全形成的二硫键也可能有助于酸性或碱性物质的产生。 传统上使用等电聚焦凝胶电泳(IEF)分析mAb电荷变异体。这种半定量劳动密集型方法依靠染料染色进行检测。它还具有通量低,缺乏自动化和可重复性差的问题。毛细管IEF(cIEF)克服了IEF的大部分限制,并提供了其他优势,包括高灵敏度,自动化和低样品消耗。此外,成像的cIEF(icIEF)在分析mAb电荷变异体方面已广受欢迎,因为整个毛细管成像消除了传统cIEF使用的麻烦的操作步骤。 毛细管区带电泳(CZE)可根据电荷和流体动力学半径分离mAb电荷变体。与cIEF相比,此方法可以轻松以较高通量进行平台化。CZE也可以与质谱仪在线耦合。CZE-MS已用于分析来自胰蛋白酶肽的N-连接聚糖,并分析脱酰胺和异构化位点。单次CE MS运行已证实可确认100%的一级结构并显示出多个PTM,包括糖基化,N末端Gln环化,脱酰胺和异构化。 离子交换色谱(IEX),包括阳离子交换和阴离子交换,已被广泛用于监测mAb电荷变体。IEX允许收集馏分以进一步表征。当使用pH梯度时,可以分析多个mAb,这意味着建立平台方法的潜力。强阳离子交换(SCX)色谱与弱阳离子交换色谱相比,具有相对较高的通量。当比较总体电荷分布时,IEF通常在阳离子或阴离子交换色谱法中显示出可比的结果。但是,由于分离机理的差异,观察到了不同的曲线。 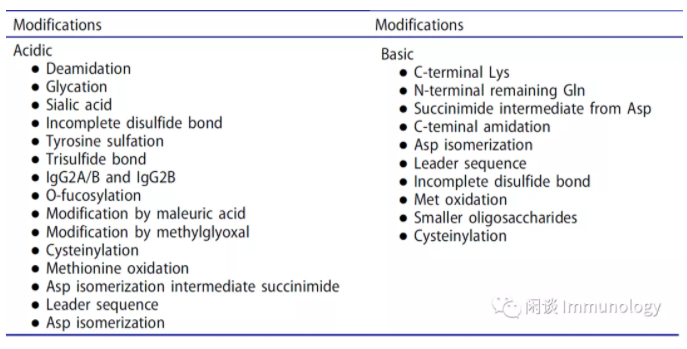
9. 疏水性和相关异质性 疏水性会影响mAb的聚集,溶解度和粘度。较高的疏水性与较高的聚集和沉淀倾向相关。CDR中的疏水性区域可导致更高程度的分子间相互作用,更高的粘度和更短的体内半衰期。 疏水相互作用色谱法(HIC)已用于测量由PTM或降解引起的不同mAb或同一mAb的单独变体的相对疏水性。与主峰相比,已报告的引起HIC保留时间变化的修饰列于表6中。某些修饰(如Asp异构化和脱酰胺作用)可同时改变HIC保留时间,这表明其他影响色谱行为的因素也参与其中。 也有文章报道了用于测量mAb相对疏水性的替代方法,例如通过盐梯度筛选使用金纳米颗粒。在这种方法中,将测试mAb加载到金纳米颗粒上,然后施加盐梯度应力以从mAb分子表面上的疏水斑块中剥离水分子。结果表明,测试的单克隆抗体与HIC保留时间具有良好的相关性。 10. 游离硫醇 大量游离Cys的存在会对mAb稳定性和效能产生负面影响。游离Cys和游离Cys相关修饰和降解的水平高度依赖于mAb序列以及细胞培养和纯化过程中的环境因素。 单克隆抗体在每个Cys残基上都含有少量的游离硫醇。游离硫醇可以降低热稳定性并增加可还原共价聚集体的形成。这些与mAb相关的游离半胱氨酸可与细胞培养基中存在的游离半胱氨酸反应,形成半胱氨酸化或其他共价加合物。在少数情况下,检测到相对较高的游离半胱氨酸水平,这主要是由于重链可变域二硫键的形成不完全,导致效能降低。 11. 蛋白质-蛋白质相互作用 由于蛋白质-蛋白质相互作用对溶解度,粘度和聚集倾向的影响,因此蛋白质-蛋白质相互作用在可开发评估期间引起了越来越多的关注。另外,体内非特异性脱靶结合导致快速清除和不良PK。 已开发出多种技术来研究mAb的蛋白质-蛋白质相互作用,包括自身相互作用和与其他分子的非特异性相互作用。在这些技术中,Biacore,生物层干涉法(BLI)和自相互作用纳米粒子光谱(SINS)已用于研究自相互作用。另一方面,当固定了不同的蛋白质时,交叉相互作用色谱法(CIC)可用于研究非特异性相互作用。CIC和HIC之间延迟保留之间的正相关关系表明,疏水相互作用是这些mAb总体粘性(非特异性相互作用)的主要促成因素。其他测定法,包括多特异性试剂结合测定法,以及与肝素,HEK293细胞,杆状病毒颗粒,伴侣蛋白和酵母菌的结合,也已用于研究非特异性相互作用。 如涉及知识产权请与我司联系
主要参考文献 Mo J, Yan Q, So CK, Soden T, Lewis MJ, Hu P. Understanding the Impact of Methionine Oxidation on the Biological Functions of IgG1 Antibodies Using Hydrogen/Deuterium Exchange Mass Spectrometry.Anal Chem 2016; 88:9495-502.
Yan Y, Wei H, Fu Y, Jusuf S, Zeng M, Ludwig R, et al. Isomerization and Oxidation in the Complementarity-Determining Regions of a Monoclonal Antibody: A Study of the Modification-Structure-Function Correlations by Hydrogen-Deuterium Exchange Mass Spectrometry. Anal Chem 2016;88:2041-50.
Yingda Xu et al,Structure, heterogeneity and developability assessment of therapeutic antibodies,mAbs,2018
Gadgil HS, Bondarenko PV, Pipes GD, Dillon TM, Banks D, Abel J, et al. Identification of cysteinylation of a free cysteine in the Fab region of a recombinant monoclonal IgG1 antibody using Lys-C limited proteolysis coupled with LC/MS analysis. Anal Biochem 2006; 355:165-74. |