▉ 前言 上一期推送中我们为大家介绍了二级淋巴器官均含有的高内皮小静脉(HEV)结构和淋巴结(一种二级淋巴器官),本期内容中我们继续探索另外两种二级淋巴器官-派尔结(Peyer’s Patches)和脾脏。 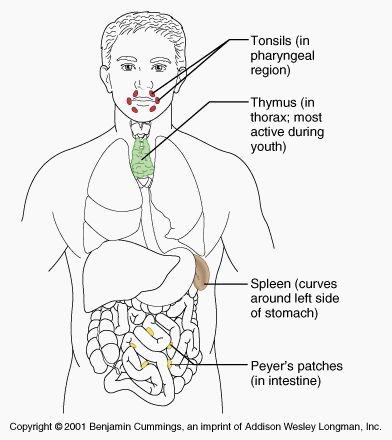
▉ 派尔结 是位于小肠上,与绒毛上皮细胞明显区分的平滑细胞团(有绒毛VS无绒毛),于17世纪晚期被瑞士解剖学家Johann Peyer发现。派尔结是黏膜相关淋巴组织(MALT)的一类,是一种重要的二级淋巴器官(小肠淋巴器官)。派尔结从胎儿出生前就开始发育,成人中大概有200个。 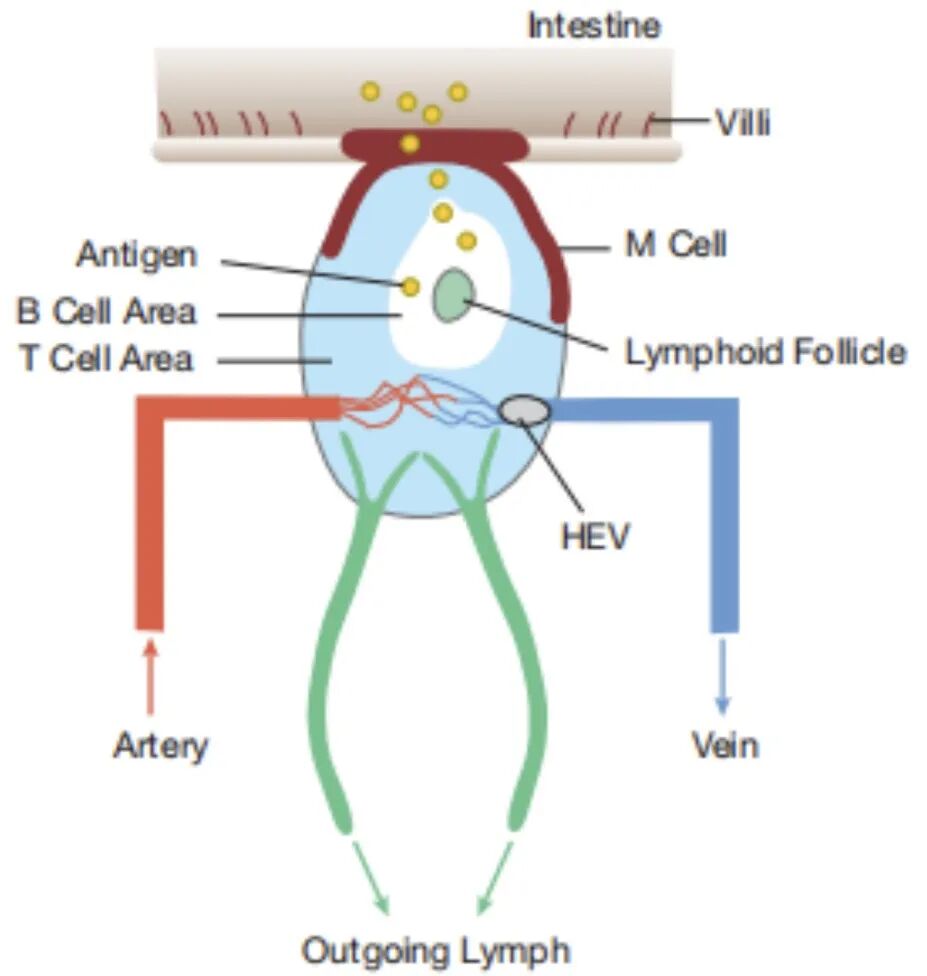
派尔结结构 与淋巴结相同,淋巴细胞通过HEV从血液进入派尔结,并通过输出淋巴管排出。但不同的是派尔结没有输入淋巴管,这就意味着抗原无法通过该方式进入(组织中抗原通过淋巴液运输)。 然而,派尔结利用位于小肠的位置优势,成功“注册”为小肠专属淋巴器官。其顶部M细胞不含绒毛,易被小肠内病原感染,进而传递危险信号。同时,M细胞也是小肠抗原“采集员”,它可将与其细胞表面分子结合的肠内抗原包裹在内体中(而对正常食糜毫无兴趣),运输至小肠周围组织。一方面,这些抗原可以在派尔结输出淋巴液带领下进入淋巴结。另一方面,当这些抗原已被抗体或补体调理过时,其可被派尔结FDC(滤泡树突细胞)捕获,提呈给T、B细胞。 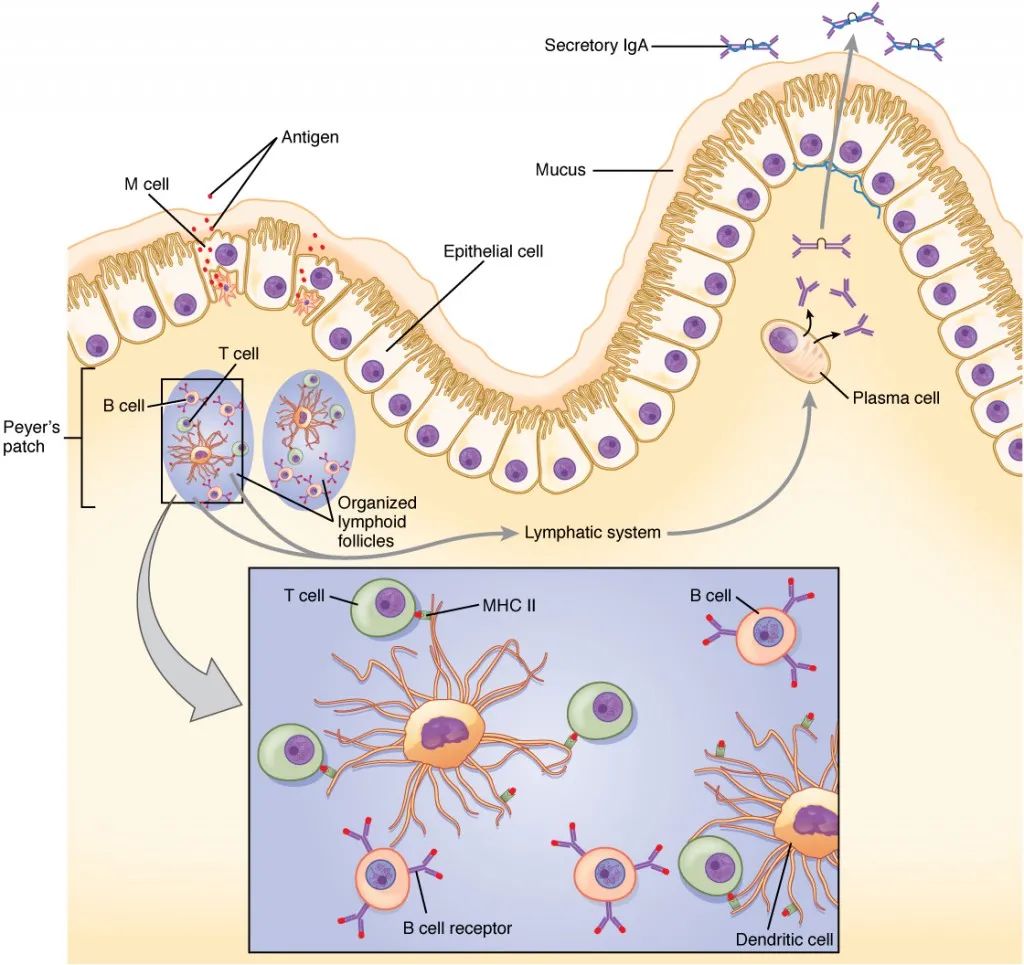 图源:https://mykosan.com/medicinal-mushrooms-fight-cancer-mechanisms/ 图源:https://mykosan.com/medicinal-mushrooms-fight-cancer-mechanisms/
▉ 脾脏
脾脏是“开放式”的。它没有输入淋巴管(与派尔结类似),也不单纯靠HEV输入T、B细胞。它位于动、静脉之间,每当心脏泵血时,都会有5%血液进入脾脏。以至于过滤一遍全身血液,脾脏只需约0.5h。 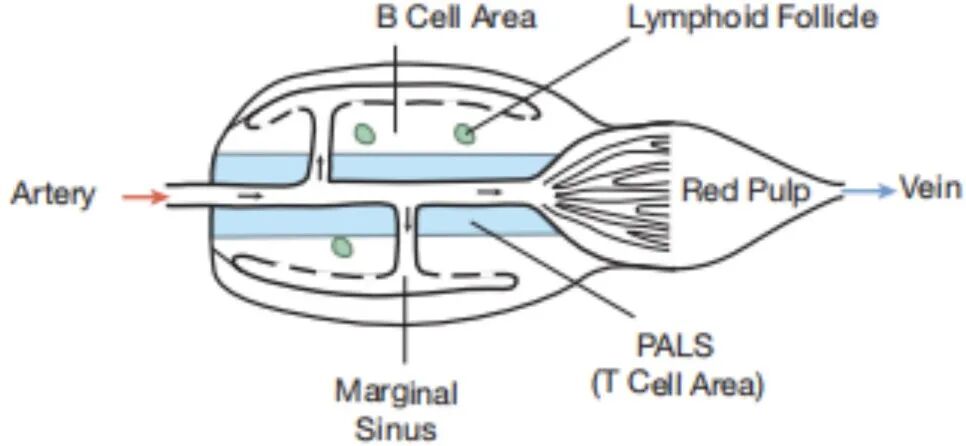
脾脏结构 脾动脉内血液在脾脏边缘窦内流淌,血液以这种方式在脾脏中徜徉,在经历一番脾脏“SPA”后,归入静脉。
其间,初始T、B细胞会出来“游玩”,T细胞进入小动脉周围淋巴细胞鞘(PALS),B细胞进入边缘窦和PALS之间区域。边缘窦内“居住”着大量树突状细胞(DC),这些“守卫”捕获流经边缘窦血液中的抗原,通过MHC II提呈。 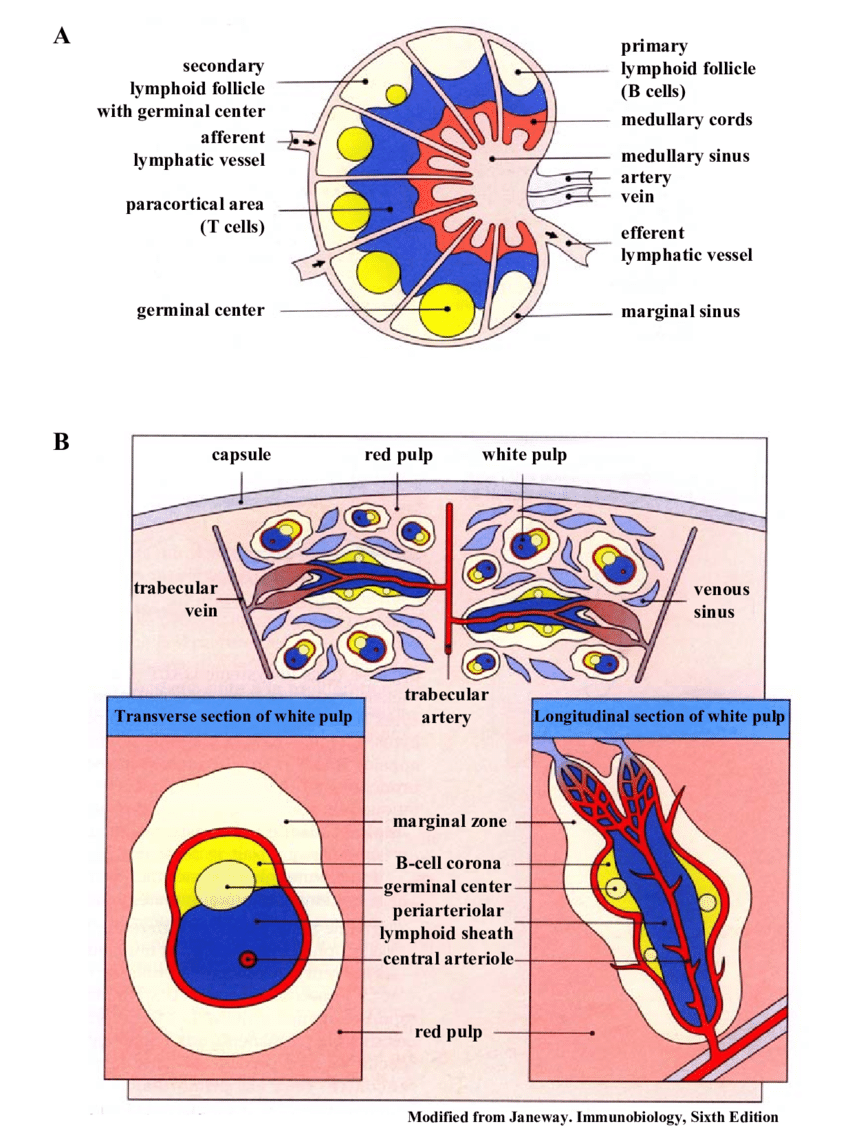
当DC被血液中的病原感染时,它会通过MHC I将信号传递出去。DC活化后,会“跑到”PALS处告知T细胞这些战役消息,辅助T细胞接受任务,去调动淋巴滤泡内“B细胞”开启战斗。然而,辅助T细胞只能接受蛋白抗原类任务,对于肺炎链球菌和嗜血流感菌这类被多糖荚膜“护体”的“高级菌”来说,辅助T细胞无能为力。 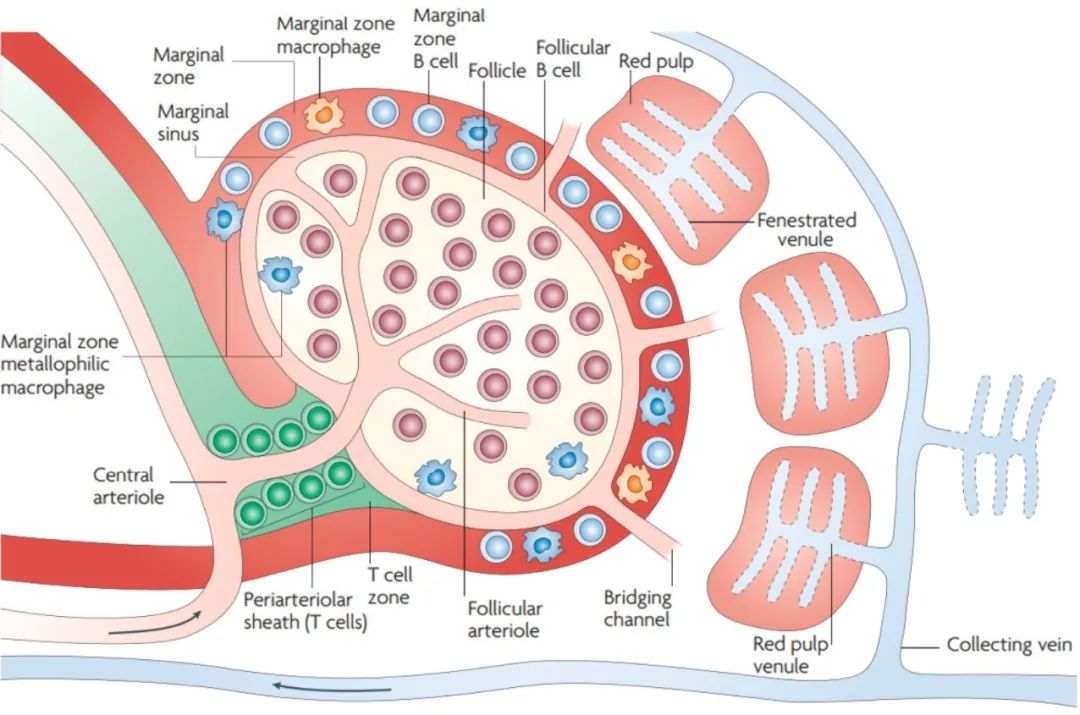
图源:《Emerging Role of the Spleen in the Pharmacokineticsof Monoclonal Antibodies, Nanoparticlesand Exosomes》 幸好,脾脏内有“超级B细胞”,它们无需辅助T细胞传递信息,也能够活化。这可能由于一方面荚膜多糖由许多重复性碳水化合物分子构成,这种B细胞含有表位聚集在一起的成簇BCR;另一方面,这些B细胞通过模式识别受体和补体受体辨别危险细菌。这些B细胞就驻扎在边缘窦外边,“重兵搜查”进入脾脏的血液。如此“重兵”配置,就减少了荚膜菌的繁殖时间,降低了战役的难度。 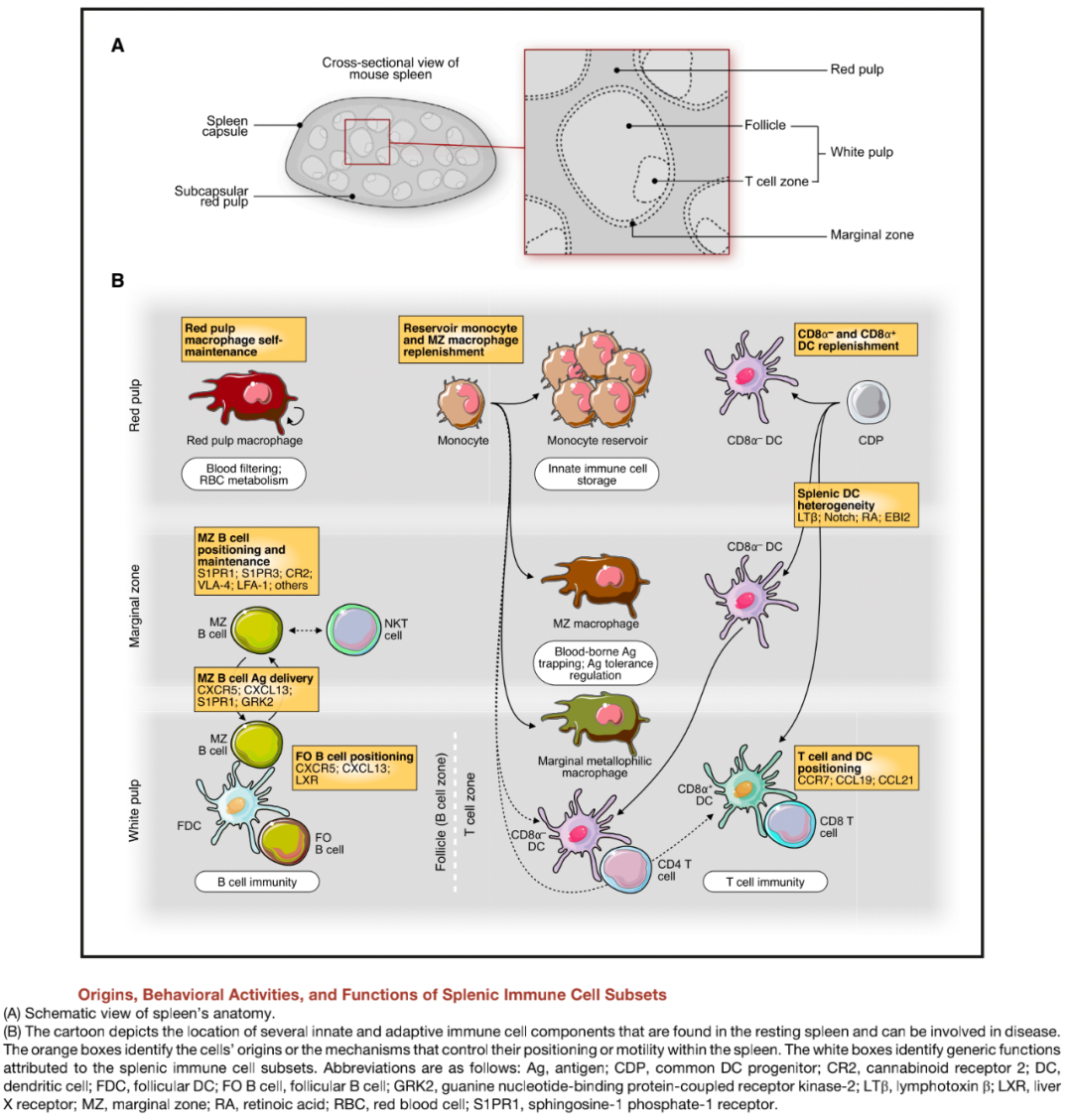
图源:《The Spleen in Localand Systemic Regulation of Immunity》 ▉ 下期预告 本期推送中,我们为大家介绍了有别于淋巴结的两种重要淋巴器官-派尔结和脾脏。下期推送中,我们将开启新的内容,介绍免疫系统的恢复,即从活跃的免疫反应中恢复过来,防止反应过度。敬请期待。 如涉及知识产权请与我司联系
|