西晋司马彪有诗云“卞和潜幽冥,谁能证奇璞” “奇璞”寓意珍奇美玉或才智出众之人
仿制药质量和疗效一致性评价政策出台、药品集采升级、“国谈”常态化的影响下,me-too等创新药和仿制药的价值空间被极大压缩,加速了药品行业业态的不断调整和发展,激发创新药研发动力,驱动着药品质量升级,拥有自主知识产权且疗效确切的药品或具有真正意义创新药的药企方能乘风破浪。
——❖——
2022“奇璞奖”历时三个多月的创新项目征集,得到了全国各地健康产业人士的积极响应和支持。最终,经过评审组的严格筛选,260多个创新项目(数量同比增幅超过40%)成功进入第四届“奇璞奖”入围名单。
让我们通过梳理2022奇璞奖「药品行业创新」赛道入围项目的亮点,一起看看药企如何乘风破浪、一骑绝尘吧~
上海辉启生物医药科技有限公司 「基于免疫治疗疾病的小分子药物研发」 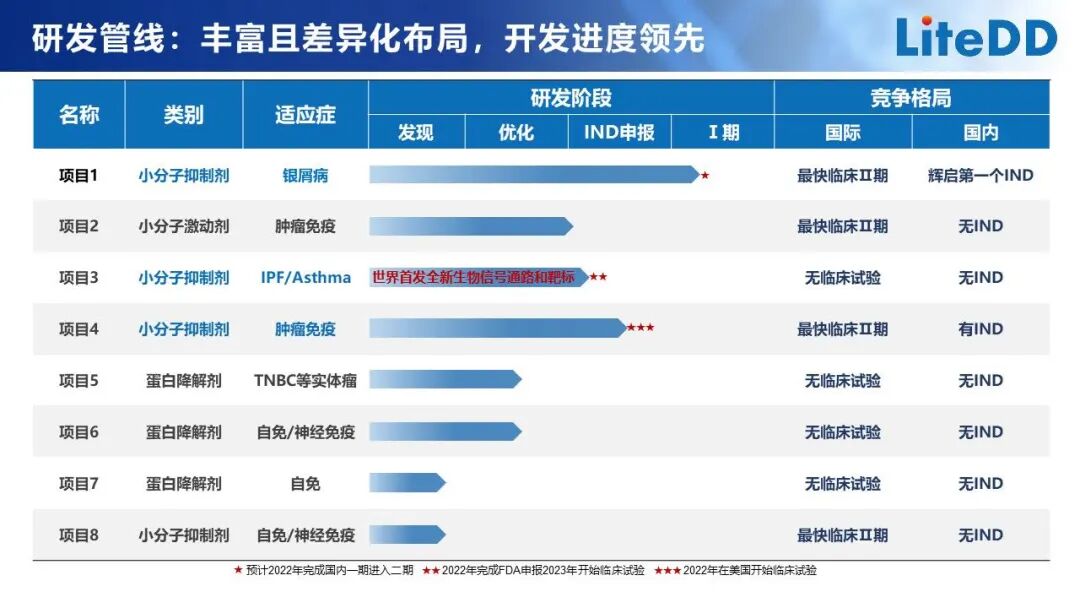
上海辉启生物医药科技有限公司成立于2018年,专注于自身免疫、肿瘤免疫和神经免疫疾病领域,已快速发展成为国内领先的聚焦先天淋巴细胞免疫的FIC创新药研发企业。
其特色是: 1、创造性地提出了全新的化合物库的设计理念,建立了独特创新的蛋白降解剂高通量筛选技术,通过巧妙新颖的设计解决了困扰蛋白诱导降解分子发现领域的难题。
2、已建立了以精准疾病机制引导的基于先天淋巴细胞免疫技术、蛋白诱导降解分子高通量筛选技术和临床转化医学技术的创新药物研发平台,呈现出快速发展的研发产品管线。
目前已获得4个项目的PCC,其中1个项目获得了FDA和NMPA临床试验许可,正在开展国内临床1期研究;另2个正进行IND使能研究,其中一个是基于自有技术于世界上首次发现的靶标用于治疗IPF和哮喘的小分子候选药物,另一个是基于公司自身转化医学技术发现的全新作用机制的FIC小分子,对带有特定生物标记物的肿瘤具有很好的疗效。
优时比贸易(上海)有限公司 「针对育龄期女性类风湿关节炎的治疗药物希敏佳(培塞利珠单抗)」  
2021年中国开放“三孩政策”,对人口长期均衡发展具有重大意义。然育龄期女性健康,需要更多关注。类风湿关节炎是一种以侵蚀性关节炎为主要临床表现的自身免疫疾病,患者备受疾病折磨,尤其对于正值育龄期的女性患者而言,如果未能得到有效治疗还会被迫推迟或改变生育计划。
优时比是一家全球性生物医药公司,总部位于比利时布鲁塞尔,专注于开发免疫系统和神经系统重症疾病的创新药物和疗法。其开发的创新产品培塞利珠单抗注射液(CZP),用于中重度活动性类风湿关节炎治疗,从分子结构的设计上就考虑到女性患者的特殊关切点,几乎无胎盘转运,是中国获批唯一在说明书中注明如有临床需要孕期全程均可使用的治疗类风湿关节炎的生物制剂。
其特色是: 根据美国、欧洲、英国多个国家的权威指南,培塞利珠单抗注射液(CZP)是目前唯一的一种被明确推荐在有临床需求时,可用于备孕期、妊娠期全程和哺乳期女性风湿病患者的TNF-α抑制剂。中华风湿病学会《风湿性疾病患者围妊娠期药物使用规范》指出,培塞利珠单抗为妊娠期首选TNF抑制剂。
同时,为提升患者可及性与可负担性,优时比积极发展商业健康险,并在持续探索更广泛的慢病用药保障,以及积极的与有关部门、行业协会及合作伙伴携手提升风湿疾病的诊疗及疾病管理水平。
亚盛医药 「中国首个且唯一一个第三代BCR-ABL抑制剂:奥雷巴替尼(商品名:耐立克®)」 
获得性耐药一直是慢性髓细胞白血病(CML)治疗的主要挑战,尽管随着靶向BCR-ABL的酪氨酸激酶抑制剂(TKI)的问世,CML的治疗方式得以革新。但仍有部分患者因耐药导致疾病进展甚至死亡。其中,BCR-ABL激酶区突变是TKI治疗后耐药的重要机制之一,T315I突变是最常见的耐药突变类型,在耐药CML中的发生率达25%左右。携T315I突变耐药CML患者对所有一代、二代BCR-ABL抑制剂均耐药,此前长期面临无药可医治的窘境。
打破无药可医 亚盛医药原创1类新药耐立克,于2021年11月获批在中国上市,是中国首个且唯一一个获批上市的第三代BCR-ABL抑制剂,打破了中国携T315I突变耐药CML患者长期无药可医的困境。
具全球Best-in-class潜力 临床数据显示,耐立克的疗效媲美全球首个上市的第三代BCR-ABL抑制剂;安全性初步显示更优。
目前,耐立克共获3项美国FDA孤儿药资格认定和1项欧盟孤儿药资格认定,并获1项FDA审评快速通道资格。
上海宇耀生物科技有限公司 「AI引领创新小分子药物研发」  
宇耀生物以“专注创新,造福人类健康”作为企业使命,专注自有知识产权创新药物的开发与研究,目前已搭建GPCR药物开发平台、“Undruggable”药物开发平台和AI药物辅助开发平台3大全球领先的技术平台;在研的8款创新产品,针对难治及复发性实体瘤、血液肿瘤,神经退行性疾病以及自身免疫病等疾病种类进行全方位布局。
YY001是宇耀生物自主研发的新一代EP4受体小分子拮抗剂,也是国内首个自主原研高选择性EP4受体拮抗剂,通过靶向肿瘤免疫微环境,治疗PD-1抗体敏感和不敏感的晚期实体瘤。
YY001目前正在上海东方医院开展临床1期研究,相较处于临床试验各阶段的竞品,临床前研究数据显示,其靶点活性提高了5-10倍, 口服生物利用度提高2倍,体内血药浓度提高了4倍,是一款有潜力的“first-in-class”产品;临床前药效研究显示其在结直肠癌、胃癌和前列腺癌等晚期实体肿瘤中表现出显著的抗肿瘤作用,并且在和PD-1抗体联用时显著增强治疗效果,有望将PD-1抗体治疗不敏感的“冷肿瘤”转变为“热肿瘤”,为晚期实体瘤的治疗提供新的策略,造福更多的中国乃至全球晚期癌症患者。
荣昌生物制药(烟台)股份有限公司(两个创新项目) 「治疗自身免疫性疾病的双靶标TACI-Fc融合蛋白--泰它西普」 
泰它西普(泰爱®)是由荣昌生物自主研发的全球首款、同类首创(first-in-class)的注射用重组B淋巴细胞刺激因子(BLyS)/增殖诱导配体(APRIL)双靶点的新型融合蛋白产品。
其特色是: 具有新靶点、新结构、新机制的特点,可同时抑制BLyS和APRIL两个细胞因子与B细胞表面受体的结合,“双管齐下”阻止B细胞的异常分化和成熟,从而治疗自身免疫性疾病。
发明专利先后获得中国、美国、欧洲等国家和地区的授权,得到了国家“十一五”、“十二五”、“十三五”期间“重大新药创制”科技重大专项支持。2021年3月,泰它西普系统性红斑狼疮适应症获得国家药品监督管理局批准上市销售,并于同年12月被批准纳入新版国家医保目录。
目前,该药用于自身免疫性疾病领域的其他6个适应症(包括视神经脊髓炎谱系疾病、类风湿关节炎、IgA肾病、干燥综合征、多发性硬化症与重症肌无力等)正处于Ⅱ期或Ⅲ期临床试验阶段,系统性红斑狼疮Ⅲ期和IgA肾病Ⅱ期全球多中心临床研究正在稳步推进。
「抗体偶联药物(ADC)新药——维迪西妥单抗」 
维迪西妥单抗(商品名:爱地希®)是由荣昌生物研发的中国首个原创抗体偶联(ADC)药物。
其特色是: 以肿瘤表面的HER2蛋白为靶点,能精准识别和杀伤肿瘤细胞,在治疗胃癌、尿路上皮癌、乳腺癌等肿瘤的临床试验中均取得了卓越的临床数据。
是我国首个获得美国FDA、中国药监局突破性疗法双重认定的ADC药物。交易额刷新中国制药企业单品种海外授权的最高纪录。2021年6月,维迪西妥单抗胃癌适应症获中国药监局批准上市销售,并于同年12月被批准纳入新版国家医保目录,于12月被纳入《新型抗肿瘤药物临床应用指导原则(2021年版)》。
尿路上皮癌适应症于2021年12月获中国药监局批准上市销售,治疗乳腺癌、肺癌、胆管癌等其他适应症的Ⅱ/Ⅲ期临床研究正在推进,其中乳腺癌适应症被CDE正式纳入突破性治疗品种。
嘉和生物药业有限公司 「Lerociclib细胞周期蛋白依赖性激酶CDK4/6抑制剂」 
嘉和生物药业(简称“嘉和生物”,港股上市)是一家创新驱动型生物制药公司,强大的产品管线涵盖全球前三大肿瘤(乳腺癌、肺癌、胃肠道肿瘤)和血液肿瘤,正着力打造一个具备药物创新研发、临床前研究、临床开发、注册、CMC开发以及商业化生产的创新性、平台型、一体化公司。
据世界卫生组织国际癌症研究机构(IARC)发布的全球最新癌症数据显示,2020年中国乳腺癌新发病例数42万、死亡人数达12万例。晚期乳腺癌患者的5年生存率较低,其中占比较大的是HR+/HER2-型患者。而在中国乳腺癌患者中,HR+/HER2-型患者的占比约为62%,是HER2+乳腺癌患者人数的2.8倍,患者治疗需求巨大。
GB491(Lerociclib细胞周期蛋白依赖性激酶CDK4/6抑制剂)是由嘉和生物和美国G1 Therapeutics共同开发的一款用于治疗乳腺癌的高选择性口服型CDK4/6抑制剂。
据2020年欧洲肿瘤学术大会(ESMO)上发表的资料,GB491(Lerociclib)在HR+/HER2-晚期乳腺癌患者的2线治疗中响应率达到31.6%,相比现有中国已获批上市的CDK4/6药物呱柏西利24.6%的响应率更佳;在安全性方面,较Inbrance、Kisqali和Verzenio显示出更优的安全性和耐受性,可以通过较低的剂量限制性毒性和较少的病患监护连续给药,有望成为潜在同类最佳CDK4/6药物。
嘉和生物于2021年5月向国家药监局递交GB491两项针对HR+/HER2-局部晚期或转移性乳腺癌患者的多中心、随机双盲、安慰剂对照3期关键研究新药临床试验申请(IND)。其中:二线3期临床试验于2021年6月EC批准,并于10月完成首例患者给药;一线3期临床试验于2021年8月EC批准,于2022年1月完成首例患者给药。作为有望成为前三款面市的国产CDK4/6药物,GB491将为乳腺癌患者带来优秀的、多样性的治疗选择。
江苏恒瑞医药股份有限公司 「注射用卡瑞利珠单抗;羟乙磺酸达尔西利片」 
羟乙磺酸达尔西利片是恒瑞医药自主研发的口服、高效、选择性的小分子CDK4/6抑制剂,属于化药1类新药。
其特色是: 作为一种新型高选择性CDK4/6抑制剂,达尔西利在药物分子结构上进行了创新,引入哌啶基团,降低临床潜在肝脏毒性,具有更高肿瘤/血浆分布比例。
是中国自主研发的首个联合内分泌治疗在晚期乳腺癌Ⅲ期临床试验中获得积极结果的CDK4/6抑制剂,DAWNA-1研究入组的361例患者100%为中国患者,更贴近中国患者诊疗现状。先后被CDE授予突破性治疗品种和优先审评审批,快速通过审批上市,目前已达成全国商业销售。
达尔西利获批上市,主要是基于DAWNA-1研究 :一项多中心、随机、对照、双盲Ⅲ期临床研究,旨在对比达尔西利与安慰剂加氟维司群治疗既往经内分泌治疗复发或进展的HR+/HER2-晚期乳腺癌患者。
与欧美国家相比,我国CDK4/6抑制剂的临床应用相对滞后。作为中国首个自主研发的CDK4/6抑制剂,达尔西利将有力推动CDK4/6抑制剂的应用可及性,令更多HR+/HER2-乳腺癌患者能够从规范治疗中获益。
复星凯特生物科技有限公司 「中国细胞治疗的开路先锋 — 阿基仑赛注射液」 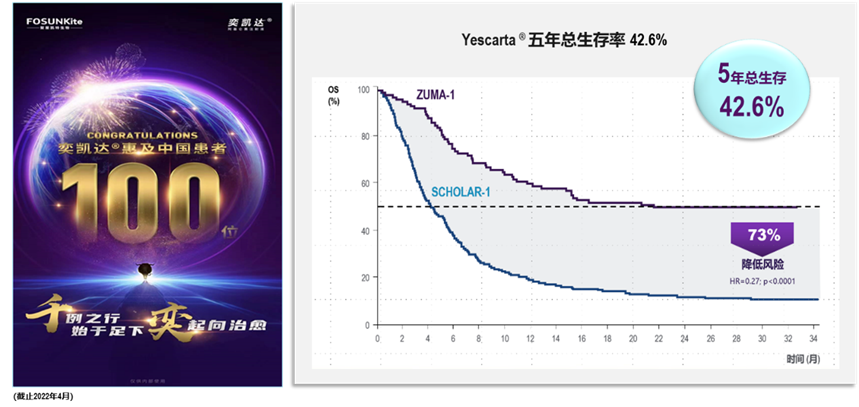
2021年6月,中国首个商业化CAR-T产品奕凯达®(阿基仑赛注射液)获批上市,开创了中国细胞治疗元年。阿基仑赛注射液是以CD19为靶点的自体CAR-T细胞疗法。
其特色是: 在三线及以上大B细胞淋巴瘤患者中进行的注册临床研究ZUMA-1显示:经阿基仑赛治疗的患者最佳客观缓解率(ORR)为83%,完全缓解率(CR)为58%;5年总生存率(OS)为42.6%。与传统疗法相比(SCHOLAR-1研究:CR 7%, mOS 6.3个月),阿基仑赛极大的提高了患者的生存获益,为患者带来可预见的治愈。
除此之外,阿基仑赛在二线大B细胞淋巴瘤患者(ZUMA-7)和三线及以上惰性滤泡淋巴瘤患者(ZUMA-5)中,均带来极为显著的疗效改善。基于此,FDA已批准阿基仑赛用于一线免疫化疗后难治或12个月内复发的DLBCL患者,和三线及以上的复发难治性滤泡性淋巴瘤患者。
针对个体化治疗模式的痛点,复星凯特开创了自体CAR-T在中国商业模式的成功先例,进行了以下创新举措:
1.医院端:通过严格的质量认证,建立规范的治疗中心;设立CAR-T运营专员,提供患者的医护服务;并在非治疗中心建立患者导流体系,扩大产品可及性。 2.支付端:携手商业保险和TPA推出了多种创新支付/保险方案,包括:分阶段付费、疗效保险、积极纳入省/市惠民保等,极大地降低患者的负担,提高了支付意愿。 3.供给端:基于奕凯达®先进的生产工艺和全流程质量管理,创新性地建立了端到端COI/COC鉴别与追溯系统,并协助政府完善行业监管,提升行业标准。
奕凯达®商业化9个月内惠及超过100名中国患者。中国真实世界的临床疗效与安全性达到甚至超过全球水平;生产和冷链物流均实现安全运营无重大偏差;并且奕凯达®已经列入近30个省/市的城市惠民保与超过40项商业保险特药目录。开创了自体CAR-T在中国商业模式的成功先例。
烨辉医药科技(上海)有限公司 「治疗慢性移植物抗宿主病(cGCHD)的药物BN101」 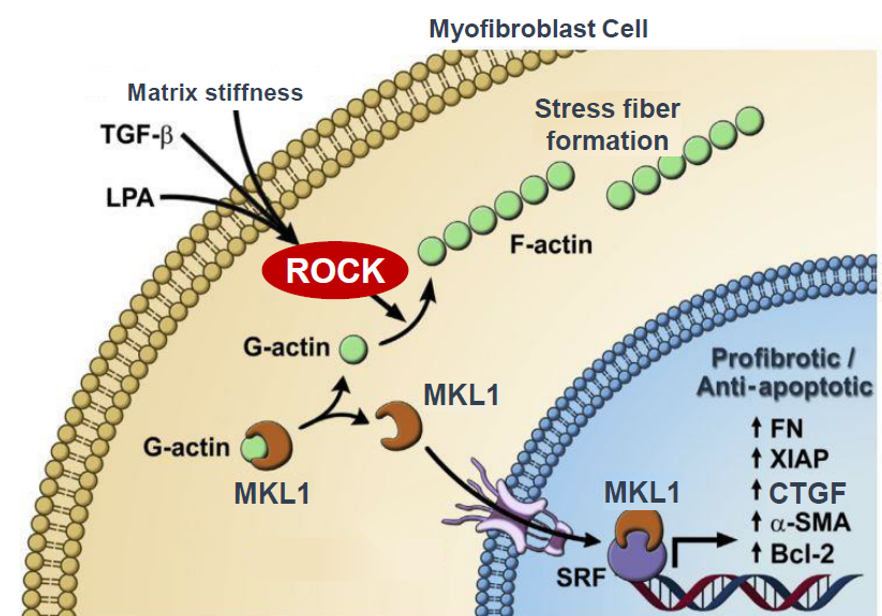 
慢性移植物抗宿主病(Chronic GVHD, cGVHD)是针对恶行血液肿瘤潜在治愈手段的异基因造血干细胞移植后常见的并发症。
在cGVHD中,移植免疫细胞(移植物)攻击患者的细胞(宿主),导致皮肤、口腔、眼睛、关节、肝脏、肺、食道和胃肠道等多个组织器官的炎症和纤维化。在我国,目前每年有一万例以上的异基因造血干细胞移植,移植后并发cGVHD的患者占30-70%。
产品REZUROCKTM / Belumosudil / KD025 / BN101(Belumosudil)是治疗cGVHD的靶向药物,于2021年7月被美国FDA获批上市。该药有潜力成为激素标准治疗失败后cGVHD的治疗首选。
其作用机制为抑制Rho相关含卷曲螺旋蛋白激酶II抑制剂(ROCK2 inhibitor),起到抗炎抗纤维化的疗效,适用于治疗既往至少2线系统性治疗失败的成人和12岁及以上儿童cGVHD患者。烨辉医药拥有belumosudil的中国权限,已完成了新药申报,等待获批上市。
浙江时迈药业有限公司 「源头创新开发技术平台 & 单/双靶向抗体药物」  
时迈药业是一家进入临床阶段的创新型生物制药企业,致力于开发治疗恶性肿瘤和自身免疫性疾病靶向抗体药物,以美国研发中心为龙头,杭州基地为依托,建立了完善的创新生物医药研发体系,自主开发了多个具全球竞争力的抗体药物开发技术平台:4个超大容量的IgM的抗体文库和高通量快速免疫文库抗体发现平台、2个完全自主知识产权的HBiBody和proBibody双特异性抗体平台及前瞻性抗体药物适应症动物筛选体系。
凭借完全自主知识产权的前沿核心技术平台,开发出一系列First-In-Class单/双抗源头创新产品,靶向多种实体瘤、血液瘤及免疫性疾病,所有产品管线序列和分子设计均来源于公司自主研发的抗体文库和双抗平台,这些功能差异性产品可解决现有临床的痛点,避免与其他公司的同质化竞争。
公司的商业模式是以完全创新药物为先导,终端产品开发与阶段性中期产品转让,技术平台授权应用或转让相结合,并可依托自身的核心竞争力,在满足自身产品管线开发的同时,也可为国内外其他制药企业提供丰富的产品输出,从而促进生物制药产业的蓬勃发展。
浙江霍德生物工程有限公司 「iPSC细胞治疗产品开发平台」  
浙江霍德生物工程有限公司拥有领先的iPSC重编程、多种定向分化细胞工程、以及iPSC基因编辑等技术优势,已获得多项自主知识产权和PCT保护。公司建立的GMP iPSC细胞株和细胞库可用于商业授权及境外申报,所建立的多种临床级iPSC衍生细胞规模化生产(包括神经、眼科、免疫细胞等)的研发平台和质量标准处于行业领先水平。
公司拥有全球领先的IPSC细胞治疗产品开发平台,以神经细胞为例,在约翰霍普金斯第一代RONA方法的基础上,公司自主研发的二代RONA神经细胞分化技术和临床级生产工艺,实现批量、稳定分化iPSC至高纯度的各种神经前体细胞,在体内外可快速分化为与人大脑的组成和功能非常接近的多种神经细胞。目前神经在研管线有:
(1)前脑神经前体细胞治疗产品hNPC01,主要针对前脑损伤引发的神经疾病,适应症为缺血性脑卒中的偏瘫稳定期后遗症,以及脑溢血、颅脑损伤等引起的后遗症; (2)脊髓运动神经前体细胞产品hNPC02,针对脊髓损伤、渐冻症等疾病; (3)中脑神经前体细胞产品hNPC03,针对帕金森氏病; (4)前脑神经前体细胞分泌的外泌体hNPC-EX,针对自闭症、阿尔茨海默氏病等。 其中hNPC01产品,预计将于2022年进行中美IND双报,目前是全球第一款针对脑卒中的iPSC衍生神经前体细胞产品。
浙江澳岚丁生物科技有限公司 「基于微生物发现及生物合成平台的抗疟疾药物」 
通过“AI+基因分析”从微生物真菌中开发各种用途基因编码小分子和生物酶,并进行大规模生物合成。通过高通量微生物学、AI机器学习、基因组工程等技术在真菌中搜索具有预定目标和生物学功能的新型基因编码小分子。与最先进的生物合成结合,推动产品规模化开发。
2022年全球防疟投入超过60亿美金。世界上每年有2亿多人患疟疾,约100万人死于疟疾。通过大数据和基因相关性分析,团队发现了疟疾在蚊子中感染的关键蛋白FREP1,并阐明了它的分子机理。针对该蛋白创立了新型高通量筛选方法,发表了世界上首个可以直接抑制蚊子体内疟原虫的天然产物-普利辛。
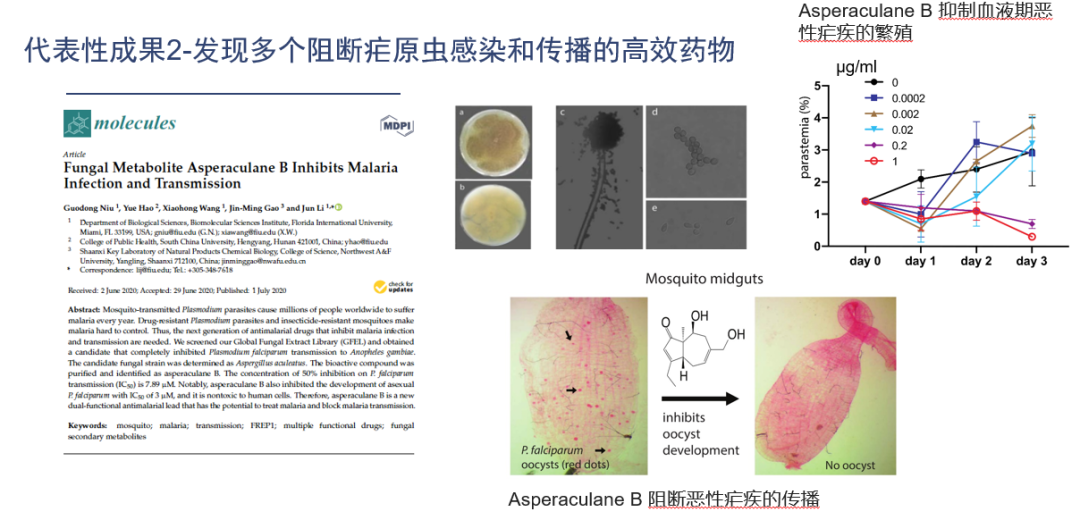
在世界上首个提出并证明通过使用天然产物喷洒至皮肤或环境就可直接抑制疟原虫在人和蚊虫两个宿主中繁殖,从而达到预防、治疗和阻断疟疾传播。普利辛的实验效果证明其对疟原虫LD50(半致死浓度)为0.2nM, LD95(95% 致死浓度)为1nM, 远远低于市场上的上一代抗疟药包括氯喹(chloroquine)和乙胺嘧啶(pyrimethamine)和新一代抗疟药青蒿素的各类延伸物例如青蒿琥酯(artesunate), 也低于一些世界卫生组织公布的正在进行临床实验的新药的浓度包括MK4815、 Mefloquine、RKA182等LD50=2mM)和乙胺嘧啶和青蒿素。
药物牧场(上海药苑/浙江药苑生物科技有限公司) 「IDinVivo+疾病靶点发现平台,Medchem5药物化学AI设计平台」  
药物牧场成立于2015年,是致力于全球首创(first-in-class)新药研发的生物科技公司。聚焦于乙肝、肿瘤、自身免疫及炎症代谢等治疗领域。
其特色是: 基于PiggyBac转座子技术的IDInVivo+药物靶点发现平台和Medchem5药物化学AI设计平台。已成功建立高效的创新靶点和新药发现平台,实现了具有完全自主知识产权的全球首创 (first-in-class)新药开发。
IDInVivo+平台所采用的piggyBac转座子技术是一种可实现在免疫健全小鼠体内进行全基因组随机基因敲除或激活的基因编辑技术。
根据正向遗传学方法先找到抑制疾病的突变小鼠,再确定该突变小鼠的基因突变,能够高效准确开发药物靶点。目前药物牧场基于此开发出多个靶点,其中一个靶点已进入I期临床试验阶段。
该案例也是中国本土企业从发现全新靶点到获批临床的第一例。Medchem5药物化学设计平台利用新型图卷积神经网络预测化合物结构和活性关系,新型对抗生成深度学习神经网络生成全新化合物结构式,新型强化学习神经网络药物化学决策AI,自动完成药物设计和资源分配。该平台亦是真正具有实用性的AI药物设计和发现手段。
该平台在2021年4月的药物设计测试中击败了5位人类药物化学家,后又在18个月内开发出一款全球首创新药,较传统方法缩短了50%的开发时间。
南京艾尔普再生医学科技有限公司 「iPS诺奖技术重磅应用——同种异体人源再生心肌细胞技术填补全球中重度心衰治疗市场空白」  
「iPS诺奖技术重磅应用——同种异体人源再生心肌细胞技术填补全球中重度心衰治疗市场空白」
心血管疾病是全球首位致死疾病,也是我国第一大疾病病种。就中重度心衰(III到IV级)而言,目前除心脏移植外,尚无其他有效治疗措施和技术。据统计,我国需要心脏移植的终末心衰患者数约为40-50万,而每年心脏移植手术仅有600例左右,在长期无心脏供体的窘境下,数十万患者无有效治疗,其两年生存期大约为50%。
基于此,作为中国难治疾病iPS细胞模型库标准化建设者,秉承“让人类健康的活到120岁”愿景的艾尔普再生医学直面临床难题,为解决心脏系统退行性疾病积极探索前沿有效治疗技术。诱导多能干细胞(iPSC)的出现打破终末期心衰患者只能通过心脏移植挽救生命的现状,其再生的心肌细胞具备低免疫原性,且与天然心肌细胞有相似的电生理特性,更容易与宿主心脏进行整合。
作为全球领先的基于iPSC创新治疗技术的探索者,艾尔普再生医学潜心开发通用型细胞药物,其中用于中重度心衰的细胞治疗项目已取得国内首个国家卫健委基于iPSC技术的临床研究备案资质,并已进入全国多个权威临床医学中心。
艾尔普再生医学始终践行“Live Better&Longer”,努力为临床患者提供安全且可负担的创新型细胞治疗产品,为“让人类健康的活到120岁”贡献力量!
信念医药科技(上海)有限公司 「基于AAV载体的血友病基因治疗药物」 
信念医药自主研发的BBM-H901注射液是以重组腺相关病毒(rAAV)为载体的血友病B基因治疗药物,采用了拥有完全自主知识产权的肝靶向性血清型和高效基因表达盒,运用了自主开发的、全球领先的大规模无血清悬浮培养和层析工艺技术。
与传统药物相比,这种血友病基因疗法打破了血浆原料限制,不依赖于血浆原料,没有血浆供应不足的风险。患者治疗成本也大幅下降,治疗费用从每周数次针剂,变为终生只需一次性注射或数年一次,总治疗费用大大降低。与国外研发的同类竞品相比,该产品更加安全低毒,适用人群更广,药物生产成本更低。
本产品自2019年就开始研究者发起的临床研究,目前已完成临床单次给药后最长2年多的患者随访,并且已经进入注册临床阶段。目前临床研究中的患者临床疗效及安全数据均良好,同时整体临床研究结果已于2022年5月发表于国际血液学权威期刊《柳叶刀-血液病学》(The Lancet Haematology)。
本产品是国内第一个进入注册临床试验阶段的血友病AAV基因治疗药物,也是中国乃至亚洲第一个静脉给药的罕见病基因治疗药物。
西湖生物医药科技(杭州)有限公司 「工程化红细胞治疗药物」 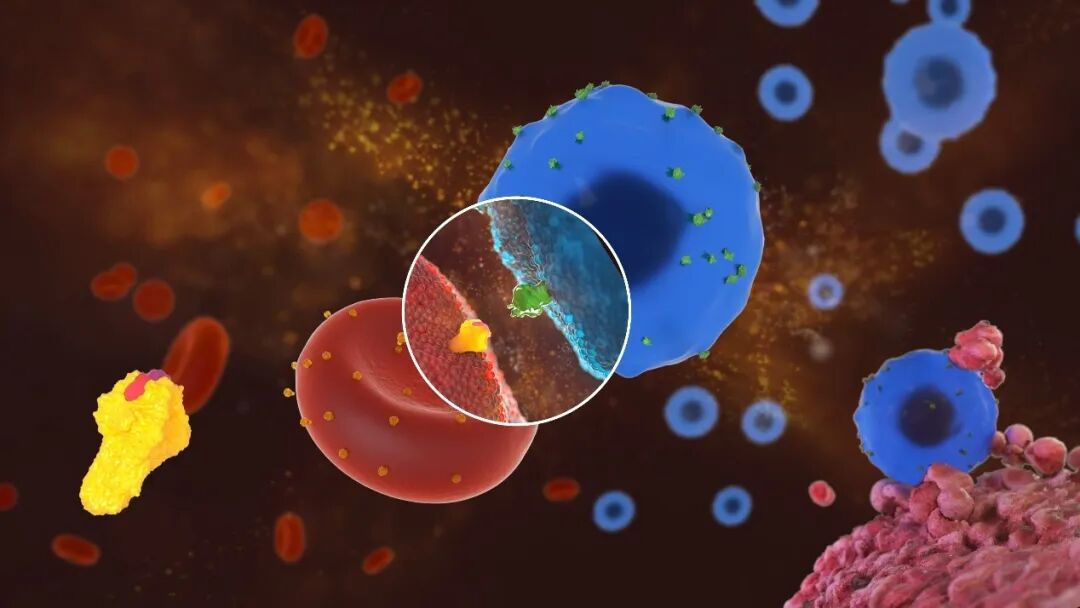
近年来,细胞技术在多种难治性疾病的临床研究上获得了许多成绩,以细胞治疗为核心的替代或再生治疗为束手无策的、严重危害人类健康的各种慢性或退行性疾病的治疗与康复带来了希望。
红细胞作为一种新型细胞疗法,不同于其他免疫细胞疗法,其在安全性上展现了独有的优势。利用造血干细胞和基因编辑技术“创造新的红细胞”是近年科学家们开发的新技术并且发展迅速。
西湖生物医药的技术平台REDx是国内首个红细胞药物技术平台,完全自主开发了成体红细胞直接负载药物的平台。
其特色是: 1、思路的创新。项目通过基因工程手段打造治疗型红细胞平台。以工程化红细胞为药物载体进行肿瘤的治疗,这在国内,尚属首次。
2、技术的创新。研发的新技术极大地提升了在红细胞表面的蛋白表达量,使得每次仅需输入少量治疗型红细胞即可产生明显生物学功能。同时,工程化红细胞会被自动清除,不存在滞留情况,降低了副作用。
3、实用性的创新。项目开发的基于外周血进行红系诱导分化培养技术弥补了脐带血或骨髓取材困难的缺点,具有更好的实用性。
4、市场差异化策略的创新。公司的红细胞治疗产品技术作为国内唯一一个从事红细胞研究的前沿技术,在市场方面拥有着强大竞争力。公司拥有两条红细胞药物搭载制备技术路线,即:通过造血干细胞构建红细胞药物载体,以及利用成熟红细胞直接进行药物搭载。
5、工艺开发的创新。红细胞的规模化生产要求有一系列的工艺开发过程,能够第一个摸索并被开发出的适用工艺将有极大机会成为该行业的标准,而西湖生物就是工程化红细胞规模化生产这项工艺开发领域的先行者。
西湖生物作为西湖大学成功孵化的第一家转化落地公司,经过两年多的发展,拥有针对癌症、免疫与代谢等重大疾病的多个first-in-class细胞药物研发管线。通过改造成熟红细胞与干细胞来源红细胞,可以生产多种用于治疗与诊断的细胞产品。同时,开放的红细胞工程化技术平台,能够高效携带多种类型药物并在体内靶向与长期作用。
西湖制药(杭州)有限公司 「靶向冠状病毒核心蛋白酶非共价小分子抑制剂药物研发」
2020年初疫情爆发以来,西湖大学快速响应国家号召,以生命科学学院院长于洪涛教授领衔,联合王廷亮、胡奇、黄晶教授等团队,集结了一支涵盖生物化学、细胞生物学、结构生物学、AI辅助药物设计、药物化学、安评毒理等多学科联合攻关队伍,聚焦靶向新冠病毒关键核心酶3CLpro开展原创小分子药物开发。
其特色是: 采用国际前沿的DNA编码化合物库筛选策略,结合端到端计算模拟和药效关系学等跨学科人工智能药物研发平台的优势,通过分子设计-药物合成-药物优化-功能验证协同创新体系,经过两年的不懈努力,项目团队获得了全新结构、机制新颖、药效显著、安全性高的非共价抑制剂药物分子,对于包括新冠病毒(COVID-19)、严重急性呼吸道综合征(SARS)和中东呼吸综合征(MERS)冠状病毒等均具有广谱抑制作用,从细胞到动物体内测试,在安全性及抗病毒有效性上均表现出明显优势。
目前,该药物分子已完成包括药代、药动、药效、药剂、安全性评估等临床前研究,依托西湖大学成果转化公司西湖制药,开展临床IND申报,力争于年内完成临床研究,将有望成为一款中国原创并拥有自主知识产权的抗新冠病毒口服小分子药物,为实施我国全面预防和治疗新冠病毒肺炎的战略任务做出贡献。
士泽生物医药(苏州)有限公司 「人多能干细胞来源多巴胺能神经前体细胞治疗帕金森等神经系统疾病的研发与产业化」

士泽生物致力于为帕金森病等一系列尚无临床解决方案的重大疾病提供规模化、低成本的干细胞治疗方案。人类多能干细胞具有在体外无限增殖和多向分化的潜能,不仅可用于疾病发生发展机理的研究以及体外药物筛选,而且为细胞替代性治疗人类重大疾病提供了新的可能。通过体外诱导分化人类多能干细胞制备功能性的细胞类型,用于细胞移植替代人体内功能损伤或退化的细胞,有望利用细胞替代性治疗手段解决人类重大疾病。
其特色是: 1、原理论证了小分子诱导神经细胞直接重编程的可行性,解析了化学重编程的分子机理(Cell Stem Cell(IF=24.6)2015年封面论文)。
2、基于重编程过程的中间态建立了全新的谱系重编程方法、大量制备不同类型的功能细胞(Cell Stem Cell 2017年度最佳论文);受到了Nature、Science、F1000等国际权威杂志和学术媒体的报道和推荐。
3、鉴定了胶质细胞命运决定的关键因子,建立了向不同亚型特化的胶质细胞的高效诱导分化方法(被评论为“了解人类大脑及其进化的重要一步”)。
目前,士泽生物已建立了快速、高效、稳定的iPS细胞株重编程、基因编辑及iPSC诱导分化等关键技术平台,拥有细胞药物安全性和有效性评价的关键动物模型;以多能干细胞分化为功能神经细胞治疗帕金森病为代表的等多条研发管线正快速、积极推进。
在李翔博士的带领下,士泽生物已自主设计并建设完成1600㎡研发中心和正建设3500㎡生产转化基地,士泽生物团队已完成iPS细胞株重编程、iPSC基因编辑平台和iPSC向不同亚型神经细胞诱导分化等关键技术平台的建设,建设完成细胞药物安全性和有效性评价的帕金森病动物模型,并布局了相关专利,所建立的iPSC研发平台和质量标准处于行业领先水平。
上海盟科药业股份有限公司 「1类抗耐药菌新药康替唑胺」
全球原创抗耐药菌新药优喜泰®(康替唑胺片)是由上海盟科药业股份有限公司自主设计和开发的新一代噁唑烷酮类抗菌药,可用于治疗多重耐药革兰阳性菌引起的感染。
自从2008年,由盟科科学家设计和发现以来,康替唑胺片已完成了中国I、II和III期临床试验,澳大利亚I期及美国II期临床试验,成功于2021年6月通过国家药品监督管理局优先审评审批程序批准上市,首个适应症为复杂性皮肤和软组织感染,并于2021年12月通过国家医保谈判纳入2021年国家医保目录。
注射用MRX-4为基于康替唑胺前药开发的注射制剂,已完成美国II期和中国I期临床试验,并已在近期启动注射用MRX-4序贯康替唑胺片的全球多中心III期临床试验,以支持注射用MRX-4和康替唑胺片未来在全球主要市场的上市申请。
其特色是: 1、对多重耐药革兰阳性菌有出色的抗菌活性。 2、临床试验未见骨髓抑制趋势,安全性好。 3、药物-药物相互作用的风险低。
盟科是一家以治疗感染性疾病为核心,拥有全球自主知识产权和国际竞争力的创新药企业,聚焦全球日益严重的细菌耐药性问题,以“解决临床难题、差异化创新”为核心竞争力,目标为临床最常见和最严重的耐药菌感染提供更有效和更安全的治疗选择。
上海诚益生物科技有限公司 「代谢及免疫疾病小分子新疗法」  
免疫及代谢系统是人类健康生活的基石,不仅抵御外界入侵,而且维持自身机体的免疫代谢平衡,因此很多疾病都源于免疫及代谢系统的失衡。诚益生物以全球领先的视角建立的新颖和差异化的研发管线项目来解决代谢和免疫相关疾病未满足的临床需求。
其特色是: 1)小分子GLP-1受体激动剂。目前市场上针对T2D和肥胖的GLP-1药物,基本上都是注射制剂为主,价格昂贵且使用、保存不便。诚益小分子GLP-1受体激动剂在降血糖基础上有显著减重及潜在心血管获益,更方便的口服方式、保存方式及更好的患者依从性,而且可支付性高。
2)肝特异性靶向的THR激动剂。是具有能全面下调低密度胆固醇(LDL)、甘油三酯(TG)和脂蛋白(Lp(a))等血脂的小分子新药,更有服药方便、可支付性高、联用性高等特点,在市场同类产品中优势明显。
3)SSAO抑制剂。目前对骨关节炎的治疗更侧重于减轻关节疼痛,而抑制关节软骨损伤、减少疾病进程的改善型新药仍未批准上市。诚益产品在抑制炎症、改善免疫代谢水平、减轻关节疼痛等方面都达到了远高于上市药物的效果。
4)针对于NASH(非酒精性脂肪肝炎)的新型口服小分子药物(联合用药)。目前在全球主流市场上还没有被批准治疗NASH的药物上市。诚益的多靶点GLP-1+THRb(NASH中前期)、SSAO(NASH中后期)联合用药,覆盖NASH病症全周期,有望缓解/治疗NASH。
上海邦耀生物科技有限公司 「世界首例CRISPR基因编辑治疗β0/β0型重度地贫患者,已摆脱输血依赖」
“地贫”是指一种由珠蛋白基因缺失或点突变致使珠蛋白肽链合成被部分或完全抑制的遗传性溶血性贫血疾病。这类单基因遗传病是我国南方人口出生缺陷的重大公共卫生问题之一。目前,全球地中海贫血基因携带者约1.8亿,每年出生的各类重症地贫患儿数至少20万;据《中国地贫蓝皮书》(2020)不完全统计,中国地中海贫血基因携带人数达3000万,中间型和重型地中海贫血患者人数达30万,且正以每年约10%的速度递增。对于轻型的β地中海贫血一般无需治疗,而中型和重型β地中海贫血一般的治疗方法有输血,铁鳌合剂治疗,脾切除及脾动脉栓塞,造血干细胞移植(hematopoietic stemcell transplantation, HSCT)等。其中,异基因造血干细胞移植(HSCT)是目前唯一可以根治β地中海贫血的方法,但费用昂贵,且配型极其困难。
如果可以将自体造血干细胞经基因校正后回输到患者体内,则可以解决造血干细胞来源不足及配型困难的问题,而CRISPR基因编辑技术的进展给这种治疗策略提供了可能。
其特色是: CRISPR-Cas9基因编辑技术是通过人工设计的sgRNA(guide RNA)来识别目的基因组序列,并引导Cas9蛋白酶进行有效切割DNA双链,从而进行基因敲除或敲入等,最终达到对基因组DNA进行编辑的目的。在利用基因编辑技术治疗地贫的过程中,体外造血干细胞的基因编辑效率与移植的成功率和疗效是直接相关的,只有编辑效率足够高才有可能达到较高比例的重建,从而产生永久的治疗效果。
目前,邦耀生物利用自主开发的基于基因编辑技术的造血干细胞平台(ModiHSC®)在治疗β0/β0型重度地贫患者的临床试验中已取得了良好的效果。自2020年7月以来,邦耀生物和中南大学湘雅医院及中国人民解放军联勤保障部队第九二三医院合作,基因治疗多例β地贫患者已治愈出院,且已摆脱输血依赖,过上了健康人的生活。
其中湘雅的2例患者摆脱输血依赖即将2年,这是亚洲首次通过基因编辑技术治疗地贫,也是全世界首次通过CRISPR基因编辑技术治疗β0/β0型重度地贫的成功案例。这一事件也代表了国内基因编辑治疗在临床研究方面的突破性成果。值得一提的是,邦耀生物在地贫领域的突出性成果已选入到第二版《中国地贫防治蓝皮书》(2020)的治疗方法部分;并且就在2022年5月31日,邦耀生物的“BRL-101自体造血干祖细胞注射液”的临床申请获得国家药监局药品审查中心(CDE)受理(受理号:CXSL2200236)。
相比其它β-地贫基因疗法动辄上千万,邦耀生物造血干细胞基因疗法则更为高效、便捷和安全,具有靶向性好、安全性高、作用范围广、治疗效果显著等优势,可以做到一次治疗终身治愈;并且成本可极大降低,有望成为更惠及大众的疗法。未来针对这一项目的研究对象年龄将进一步扩大到35岁,有望让地贫移植领域的“老大难群体”——大龄及配型无望的患者受益。
邦耀生物作为一家以“以基因编辑引领创新,开发突破性疗法,造福全人类”为使命的细胞基因药企,不断克服行业壁垒,进行多靶点的战略布局,目前在基因编辑治疗β-地中海贫血症、PD1敲除非病毒定点整合CAR-T、以及UCART等项目中已经取得优异临床效果。未来,仍将通过不断地加速推进创新药物的转化与落地,从而造福包括地中海贫血在内的全球罕见遗传疾病及恶性肿瘤患者!
中山康方生物医药有限公司 「卡度尼利(PD-1/CTLA-4双特异性抗体,研发代码:AK104)」 
卡度尼利(PD-1/CTLA-4双抗,AK104)是康方生物自主研发的新型的、首创的PD-1/CTLA-4双特异性肿瘤免疫治疗骨干药物。已经在中国、美国、澳洲开展了十余项单药或联合用药的临床研究,主要针对宫颈癌、胃癌、肺癌、肝癌、肾癌、鼻咽癌、实体瘤等大适应症。
其特色是: 1、利用其独有的技术平台“Tetrabody”研发的区别于PD-1单抗分子的四价(四结合表位)双特异性抗体,具有更好的亲和力和有效性。采用的IgG-ScFv结构,在保证具有肿瘤组织高留存的良好抗原差异化结合的基础上,可快速介导独立的PD-1或者CTLA-4内吞;此外,IgG1骨架显示了更稳定的结构特征,而引入了Fc段点突变,有效的消除了Fc段的效应功能,为卡度尼利带来了更好的安全性特征。
2、推动肿瘤免疫治疗全面进入2.0时代:以PD-1为代表的免疫检查点治疗药物开启了肿瘤免疫治疗1.0时代,卡度尼利作为同时靶向PD-1和CTLA-4两个免疫检查点分子,相比PD-1抑制剂或CTLA-4抑制剂单药或联合治疗,具有更好的临床疗效,安全性与PD-1相当。目前,康方生物以卡度尼利作为免疫治疗的“基石”产品,通过单药或联合用药,实现同时2-4个靶点的治疗效果,也可以联合其他治疗机制的药物进行抗肿瘤治疗。由此,卡度尼利将有力推动肿瘤免疫治疗进入2.0时代,改写治疗格局。
3、有效性和安全性优异,满足临床未被满足的需求:临床研究显示卡度尼利2/3L治疗转移/复发性宫颈癌针对全人群(无论PD-L1表达情况)患者的ORR高达33%,CR高达12%,PD-L1阳性表达患者的ORR高达43.8%,CR高达17.2%。的疗效数据,远高于全球已批准上市治疗药物或在研临床研究的已披露数据。目前,卡度尼利已经在中国提交2/3L治疗转移/复发性宫颈癌的上市申请,并获得优先审评,预计在2022年获批上市。中国每年新增15万宫颈癌患者,卡度尼利有望成为中国宫颈癌患者首款免疫治疗药物,填补临床需求空白。
相关肿瘤的研究阶段性数据显示,卡度尼利单抗比PD-1联合CTLA-4的联合疗法相比,毒性显著降低,具有明显的安全性和疗效优势。基于卡度尼利单抗在复发/转移宫颈癌临床研究中获得的积极效应,2021年9月,CDE已经受理卡度尼利治疗复发/转移宫颈癌的新药上市申请,并给予优先审评资格。该药物有望成为全球首款获批的双免疫检查点抗体蛋白新药,也将成为首款中国自主研发的创新双特异性抗体药物。
江苏康宁杰瑞生物制药有限公司 「新一代抗肿瘤药物 PD-L1/CTLA-4 双特异性抗体(依瑞利)的全球开发和产业化」
该项目由国家级重大人才引进工程入选者徐霆博士领衔研发,目标产品依瑞利单抗(研发代号KN046)为PD-L1/CTLA-4 双特异性抗体,是first-in-class类创新药,在分子设计、临床疗效、安全性、工艺开发等多个方面取得重大突破,处于国际领先水平。
其特色是: 依瑞利单抗能同时识别人细胞程序性死亡-配体 1( PDL1)和人细胞毒性 T 细胞抗原 4( CTLA-4),有效阻断 PD1 与 PD-L1 以及 CTLA-4 与 CD80/86 之间的相互作用,激活免疫系统,防止肿瘤细胞逃逸,同时,还可通过清除Treg的负调控作用,增强针对肿瘤的免疫反应。
依瑞利单抗属于广谱类抗肿瘤抗体药,已针对多种发病较高的恶性肿瘤在中、美同步开展多项临床试验研究,其中依瑞利单抗联合含铂化疗在晚期不可切除或转移性鳞状非小细胞肺癌患者中开展的Ⅲ期临床研究已经完成中期分析,正在进行BLA申报,有望成为我国针对大瘤种的首个上市的双抗药物。同时,依瑞利单抗用于PD-(L)1经治晚期非小细胞肺癌、晚期胰腺癌等多项注册临床研究进展顺利。
依瑞利单抗的制备工艺创新解决了多项培养基、填料、耗材等原/辅料国产化开发等“卡脖子”技术,极大地降低了生产成本,为解决大分子药物生产的瓶颈问题作出贡献。
和黄医药(两个创新项目) 
「苏泰达®(索凡替尼胶囊):全球首个覆盖所有部位来源神经内分泌瘤的中国创新靶向药物」 
2020年12月,索凡替尼(商品名:苏泰达®)获国家药品监督管理局批准上市,用于治疗非胰腺神经内分泌瘤。次年6月,其第二项用于治疗胰腺神经内分泌瘤的适应症获批,成为首个覆盖所有来源的神经内分泌瘤的创新靶向药物。这是和黄医药自主发现、研发,完成在中国概念验证试验,第一个扩展到美国进行临床研究的抗肿瘤药物。
索凡替尼是一种新型的口服酪氨酸激酶抑制剂,兼有“抗血管生成”和“免疫调节”双重活性,不仅抑制肿瘤新生血管生成,同时也可通过抑制CSF-1R来调控肿瘤微环境免疫应答,激活人体自身的免疫系统来发挥抗瘤作用。其获CSCO神经内分泌肿瘤诊疗指南(2021)最高证据级别1级推荐用于胰腺、胃肠道、肺或胸腺神经内分泌的治疗。
索凡替尼的双重活性,使其与其他免疫疗法的联合用药有着与生俱来的优势。目前,和黄医药已达成了数个全球合作协议,以评估索凡替尼与PD-1单克隆抗体联合疗法的疗效,包括替雷利珠单抗、特瑞普利单抗和信迪利单抗等。
随着索凡替尼顺利进入2022版国家医保药品目录,以及其新适应症及联合治疗的探索进一步发展,其临床价值、经济与社会效益将得到持续的提升。
历经十数载的研究,索凡替尼的出现为对于在全球范围内治疗方法都十分有限的神经内分泌瘤,提供了全新的治疗选择,也向全球医学界证明,中国创新药正在崛起,为全球未尽满足的医疗需求提供“中国方案”。
「沃瑞沙®(赛沃替尼片):中国首个选择性MET抑制剂」
由和黄医药自主研发的赛沃替尼是一款强效、高选择性的口服小分子MET抑制剂。历经十一年的研究证实,赛沃替尼在治疗MET外显子14跳跃突变的非小细胞肺癌方面展现了出色的抗肿瘤活性,同时也具有良好的耐受性。
2021年6月,赛沃替尼(商品名:沃瑞莎®)获中国国家药品监督管理局有条件批准用于治疗接受全身性治疗后疾病进展或无法接受化疗的间质上皮转化因子(“MET”)外显子14跳跃突变的非小细胞肺癌患者。
2022年5月,上海沪惠保2022版发布,赛沃替尼作为特定高额药品进入报销清单。
目前,和黄医药正展开全球合作,继续探索赛沃替尼作为单药疗法或与其他药物的联合疗法,开发用于治疗包括肺癌、肾癌和胃癌在内的多种肿瘤类型,并在中国及海外展开多项注册研究。
基于在中国人群临床研究中取得的积极结果,赛沃替尼获批上市,并列入2021版《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南》II级推荐用药,成为中国MET外显子14跳跃突变患者的治疗新选择。
作为中国首个且唯一获批应用于此类患者的创新药物,赛沃替尼不仅填补了国内MET抑制剂的空白,并且有望成为首个代表中国走向全球的肺癌靶向创新药物。
宜明昂科生物医药技术(上海)有限公司 「IMM01:新一代抗肿瘤药物开发研究」 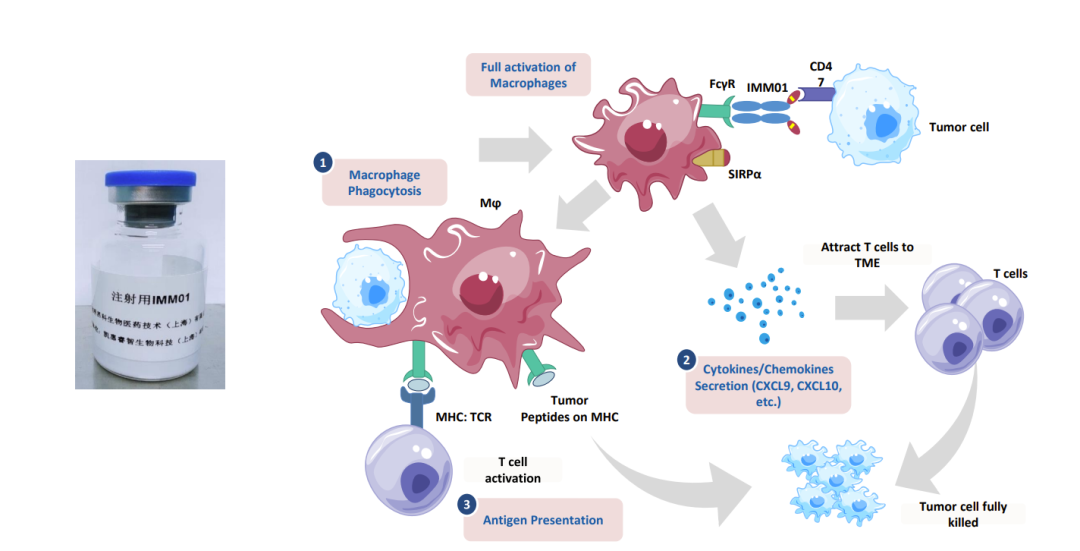
CD47靶点因其对多种肿瘤广谱的作用机制,目前已成为业界继PD-(L)1之后,最期待的下一个肿瘤免疫靶点,具有巨大的市场潜力。于2020年起,受到越来越多的业界关注,不少知名药企不惜掷重金通过外部并购、产品授权引进的方式,对CD47靶点进行布局。
CD47虽然市场空间巨大,但针对该靶点的分子设计极具挑战。很多知名药企研发的CD47抗体,均因其抗体与人体红细胞表达的CD47结合,产生很大的血毒性,而导致临床的暂停或终止。
IMM01是基于宜明昂科技术平台自有研发、经基因改造的新一代靶向CD47的SIRPαFc融合蛋白,具有全球自主知识产权。
其特色是: 1、体外不与红细胞结合,具有非常好的安全性。同时,分子设计上,采用了能够通过“吃我”信号充分激活巨噬细胞,增强下游T细胞免疫反应的IgG1 Fc。而全球大部分CD47抗体,因为其或多或少都会与人体红细胞结合,故而只能使用Fc功能效应较弱的IgG4 Fc,无法充分激活巨噬细胞。因此,我们与Trillium(被Pfizer并购)是全球范围内唯二的两家在临床上能够看到针对复发耐药淋巴瘤致使肿瘤完全缓解强大的单药有效性,并兼具良好安全性的CD47分子研发企业。
2、具有强大的联合用药潜力,IMM01与阿扎胞苷联用治疗复发难治性急性髓样白血病和骨髓增生异常综合征的Ib/II期临床研究,与PD-1抗体治疗复发难治多种实体肿瘤的Ib/II期临床研究,与三生国健合作治疗HER2阳性实体瘤的Ib/II期临床研究在同步推进,并在临床前研究中展示出强大的抗肿瘤活性和良好的安全性。IMM01强大的单药有效性也预期将使其联合用药显示出比传统CD47抗体更大的优势。
IMM01 联合PD-1抗体的临床前体内药效研究 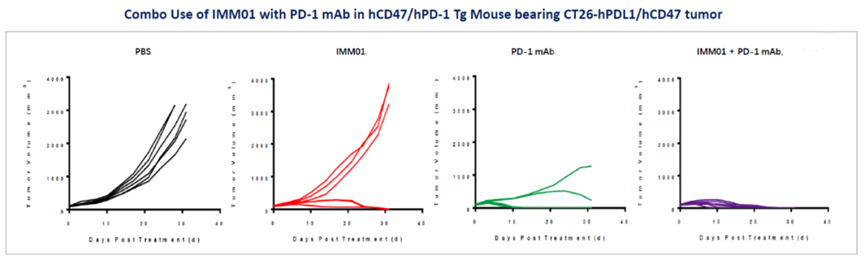
IMM01项目完美解决了CD47靶点药物研发的核心痛点,与其它同靶点药物相比具有较大的差异化优势,具有潜在全球“Best-In-Class”的药物潜力。目前已分别在中国、日本和美国获批发明专利。
注:近日,奇璞奖“入围名单”公布后引起公众广泛关注,为了让更多的民众能够及时、深入地了解健康行业的最新动态,促进大众接受并广泛运用优秀的创新成果,进而帮助优质的应用落地。组委会接受入围项目投稿,在奇璞微信公众号上分批展示。(不分排名,投稿内容会有微调,滑动可查看更多项目信息)
第四届奇璞奖致力构建创新项目展示和交流合作的平台,为推动医疗健康生态圈建设助力。欢迎医健早期创新者踊跃申报「2022奇璞种子榜单」。 如涉及知识产权请与我司联系 |