来源:医药时间医药时间
自2010年以来,针对肿瘤免疫疗法的临床捷报频传,引起科学界和资本界浓厚的兴趣。
今天,我们就继续来聊一聊肿瘤免疫疗法研究方向之基于免疫检查点抑制剂的免疫组合疗法。
免疫检查点抑制剂(anti-PD-1/L1或anti-PD-1/anti-CTLA-4)可以与化疗、靶向疗法、其他免疫检查点抑制剂、免疫共刺激因子和CAR-T疗法构成组合疗法,一方面是增强PD-(L)1的疗效,另一方面也是目前克服PD-(L)1耐药的主要策略。
简而言之,基于免疫检查点抑制剂的免疫组合疗法就是:PD-(L)1+X。这里X将是一大批不同的东西,并且它将更加个性化,具体取决于肿瘤类型。
双重阻断疗法:同时阻断CTLA-4和PD-1
已知,CTLA-4与CD28竞争CD80/CD86配体,从而阻断CD28共刺激信号,而CD28信号是T细胞活化和效应体功能强大所必需的。
同时阻断PD-1和CTLA-4增加黑色素瘤中T细胞浸润并减少Treg(调节性T细胞)和骨髓源抑制细胞数量,可进一步提高黑色素瘤患者的总生存率,这在PD-L1高表达的患者中变现更明显。
目前,抗CTLA4和PD-1的双重阻断疗法已经在治疗晚期黑色素瘤、非小细胞肺癌和肾细胞癌方面已经取得了成功,并且获得了FDA批准。
2015年,Ipilimumab(抗CTLA-4)和Nivolumab(抗PD-1)联合治疗晚期黑色素瘤获得FDA批准。
基于III期试验数据显示,与单独使用两种药物相比,Ipilimumab和Nivolumab联合使用,一方通过阻滞上调对T细胞的启动控制,一方则改变肿瘤微环境,最后在晚期黑色素瘤患者中表现出前所未有的58%的反应率和11.5%的完全缓解率,从而也增加了临床采用组合疗法的合理性。
当然,与此同时,该组合也带来了更为频繁的不良反应:24%的患者甲状腺受到影响,垂体功能障碍(主要是垂体炎)者占9%,出现肾上腺功能不全(AI)者占4%,这一结果明显高于Nivolumab单药治疗组。
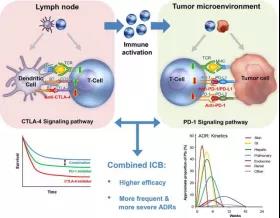
Ipilimumab和nivolumab治疗提高了反应率和完全缓解率
抗LAG3+抗PD-1协同增强抗肿瘤免疫作用
淋巴细胞活化基因3(LAG-3)被证明是一种免疫抑制受体,通常在活化的传统T细胞、TREG细胞、B细胞和浆细胞样树突状细胞上表达。LAG-3调控一个限制T细胞激活的检查点通路

一直认为的MHC-II是LAG-3的主要配体
LAG-3和PD-1受体在黑色素瘤的肿瘤浸润淋巴细胞上过度表达和/或同时表达。目前已证明,同时阻断LAG-3和PD-1可协同恢复T细胞活化,增强抗肿瘤免疫。
在百时美施贵宝公司开展的1/2a期研究中,联合使用二者的抗体药物([BMS- 986016]+[Nivolumab])显示出良好的抗癌活性。
在后期更大范围的联合治疗试验中:
-
截止2017年6月15日,共治疗68例患者,57%的患者曾接受过抗CTLA-4药物治疗,46%的患者曾接受过3种药物治疗;
-
在61例有效评估的患者中,ORR(客观缓解率)为11.5%,DCR(疾病控制率)为49%;
-
无论PD-L1表达与否,LAG-3表达超过1%的患者其响应率比LAG-3表达小于1%的患者高出3.5倍。
综合反映出二者联合使用良好的抗肿瘤疗效。
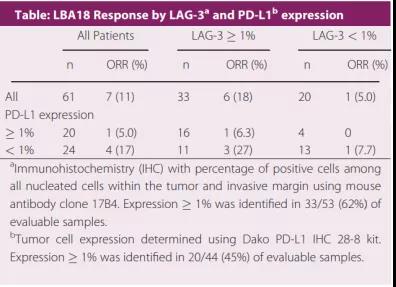
联合治疗试验结果一览
溶瘤病毒注射促进肿瘤内T细胞浸润,改善抗PD-1免疫治疗
溶瘤病毒是一类能有效感染并消灭癌细胞的病毒。从机理上看,它不仅能直接杀伤肿瘤,而且还能刺激人体免疫反应,也可与免疫检查点抑制剂联合使用,增强免疫治疗敏感性。
以Talimogene laherparepvec(T-VEC)溶瘤病毒为例。
T-VEC是一种经基因改造过的1型单纯疱疹病毒,可选择性地在肿瘤中复制并产生粒细胞-巨噬细胞集落刺激因子(GM-CSF),从而增强抗原释放、表达和全身抗肿瘤免疫反应。
在之前的3期临床试验中,与皮下注射GM-CSF相比,肿瘤内注射T-VEC治疗晚期黑色素瘤的持久反应率有所提高。而其与CTLA-4抑制剂Ipilimumab联合试验则显示了比单独使用Ipilimumab更好的抗肿瘤活性,且无额外毒性,这些结果是非常令人鼓舞的,特别是在溶瘤免疫治疗领域。 在一项由加州大学洛杉矶分校参与开展的,针对21例晚期黑色素瘤患者联合T-VEC与PD-1抗体药物Pembrolizumab治疗1b期临床试验中发现,
-
肿瘤的客观缓解率高达62%,其中33%为完全缓解;
-
而对联合治疗有反应的患者,在T-VEC治疗后,其肿瘤中CD8+T细胞增多,PD-L1蛋白表达升高,多个肿瘤细胞亚群中IFN-γ基因表达增加;
-
联合治疗的反应似乎与基线CD8+T细胞浸润或基线IFN-γ信号无关。
这些结果提示,这一联合疗法的缓解率高于单独使用Pembrolizumab或T-VEC治疗的预期缓解率(通常约为35%-40%)。
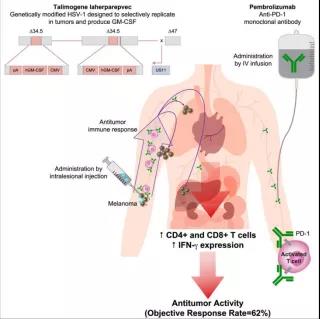
溶瘤病毒结合抗pd -1治疗增强了对癌症的免疫识别,导致晚期黑色素瘤患者的高反应率
免疫治疗+抗血管治疗
联合其他治疗方法,包括抗血管生成药物,是目前正在研究的许多提高免疫治疗反应率和持续时间的策略之一。事实上,血管生成和免疫抑制被描述为可以同时发生的密切相关的过程。两者都是参与非病理组织修复的生理机制,可用于肿瘤治疗。
有趣的是,抗血管生成药物会增加肿瘤缺氧并减少肿瘤内血管的数量。另一方面,各种促血管生成分子已被证明存在于癌症免疫循环的连续步骤中,如抗原递呈→T细胞启动→T细胞转运→T细胞肿瘤浸润,与一系列免疫抑制作用有关。
T细胞不能进入肿瘤的一个原因可能是物理和生化障碍。肿瘤的一个标志性特征是产生异常组织结构,肿瘤的血管网络和很多细胞外基质蛋白的表达都发生了显著变化。肿瘤的血管网络通过导致黏附分子的调控失常防止T细胞的迁移,这是T细胞浸润的一大障碍。同时,肿瘤增生造成的缺氧环境也有利于产生免疫抑制的肿瘤微环境。
值得注意的是,肿瘤包括热肿瘤,即周围有活化的肿瘤浸润淋巴细胞(TILs),还有“冷”肿瘤,即边缘缺少TILs或是被排斥的淋巴细胞。肿瘤中免疫细胞浸润的存在或缺乏是影响多种免疫治疗效果的重要方面。
目前正在研究的各种治疗策略,目的就是重塑肿瘤微环境,使得肿瘤血管正常化,血管网络正常化,以减少缺氧环境,提高1型辅助T淋巴细胞的浸润和活性,使得免疫功能得到恢复。
而调控血管生成的分子可以通过至少三种方式影响免疫细胞及其与肿瘤的相互作用:
-
当它们与免疫细胞表达的同源受体结合时产生直接影响;
-
诱导内皮细胞蛋白表达改变的间接效应;
-
通过促进血管正常化或减少新生血管而产生的间接物理效应。

血管生成调节因子对免疫系统有三种既定的影响
2019年,拜耳、BMS和Ono三家公司签订临床合作协议,评估拜耳的激酶抑制剂Stivarga(regorafenib)和BMS/Ono的抗PD-1单抗Opdivo(nivolumab)联合使用的疗效。该疗法用于治疗微卫星稳定性转移性结直肠癌(MSS mCRC)患者。
这里提到的Stivarga能够抑制促进肿瘤生长的多种激酶,其中包括介导VEGF信号通路的激酶。
一项称为REGONIVO的1b期临床试验中,Stivarga和Opdivo联用显示出了良好的初步疗效:
-
ORR为40%(98%CI 26~55),疾病控制率(DCR)为88%(95%CI 76~96);
-
GC患者治疗反应率为44%,所有对治疗存在响应GC患者均微卫星稳定(MSS);
-
MSS的CRC患者治疗反应率为33%,CRC患者人群的总体治疗反应率为36%;
-
对比治疗前后,出现肿瘤客观反应的患者中可观察到FoxP3hiCD45RA-Tregs的减少。
此外有研究证明,在结直肠癌CT26小鼠模型中使用抗PD-1抗体联合抗VEGF抗体后,抗肿瘤效果得到改善,与对照组相比,肿瘤生长平均降低约75%。同样,在注射了小鼠结肠癌C26细胞的肿瘤小鼠中,与单独治疗相比,联合使用抗VEGFR2和抗PD -1单克隆抗体治疗可增强对肿瘤生长的抑制作用。可见免疫治疗联合抗血管治疗的优良前景。
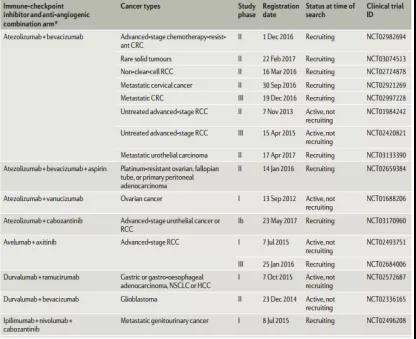
部分临床组合试验进程一览
随着免疫系统针对新靶点研究的不断推进,以及相关临床试验的广泛开展,我们相信,肿瘤免疫组合疗法也将迎来更多可能,从而在响应率及不良事件改善率方面呈现更好的效果~
|