来源:弗雷赛斯
今天和大家讲下老牌杂志Elife IF:7.551上的一篇有关免疫治疗预测标志物的文章。

1.研究背景
如今以免疫检查点抑制剂(ICI)为代表的免疫治疗正在改变癌症的治疗。然而,只有一小部分患者对ICI有反应,并且如今对可以识别出哪些患者更有可能对免疫治疗有反应的生物标志物仍有广泛的需求。ICI反应的基础是肿瘤的免疫原性,免疫原性主要由肿瘤的抗原性和抗原呈递效率决定。在此,作者提出一种测量肿瘤免疫原性评分(TIGS)的方法,该方法结合了肿瘤突变负荷(TMB)和抗原处理呈递机制(APM)的表达特征。无论是与泛癌ICI反应率(ORR)的相关性,还是对个体患者的ICI临床反应预测,TIGS始终比TMB和其他已知的ICI反应预测生物标志物表现出更好的性能。本研究表明TIGS是一种有效的肿瘤内在生物标志物,可用于ICI应答预测。
2.材料和方法
1) 泛癌的临床、基因表达以及免疫数据:下载33个TCGA组的泛癌水平RNA-Seq数据和临床信息;从GEO数据库下载细胞癌、皮肤鳞癌和小细胞肺癌的微阵列基因表达数据集。
2) GSVA:采用GSVA法定量分析APM基因在免疫细胞类型中的表达状态和浸润水平。
3) 评估免疫浸润得分:样本免疫渗透得分(IIS)被定义为巨噬细胞,DC子集,B细胞,细胞毒性细胞、嗜酸性粒细胞、肥大细胞,中性粒细胞,NK细胞子集,和所有的T细胞亚群的标准化值。
4) 用于TIGS计算的APM评分标准化:公式如下APSnormalized= APS−APSpancan_minAPSpancan_max− APSpancan_min
5) 用于TIGS计算的TMB数据的标准化:TMB被定义为每百万碱基(Mb)基因组的非同义改变数。
6) TIGS估算:使用公式TIGS= APSnormalized × log(TMB),这里用的是自然数。值得注意的是,一些肿瘤的TMB水平低于1个突变/Mb,因此在量化“肿瘤抗原性”时为避免出现负数,公式如下TIGS= APSnormalized × ln(TMB +1)。
3.研究结果展示
①APM 评分定义以及泛癌分析
抗原处理和呈递的效率是决定肿瘤免疫原性的一个因素。在这里,作者使用APM过程中涉及基因的mRNA表达状态作为这些抗原处理和呈递步骤效率的指标。采用GSVA方法检测APM基因的整体表达富集情况。在查阅文献的基础上,以下基因被选择:PSMB5, PSMB6, PSMB7, PSMB8, PSMB9,PSMB10, TAP1, TAP2, ERAP1, ERAP2, CANX, CALR, PDIA3, TAPBP, B2M,HLA-A,,HLA-BHLA-C(图1)。GSVA计算每个样本一个特定基因的过表达水平,得到的GSVA评分被定义为APS。为了探索APS的泛癌分布模式,作者分析了TCGA中32种癌症类型的约10,000个肿瘤(图1)。图1A的箱线图显示了TCGA癌症类型中APS的巨大差异,这揭示了不同癌症类型之间在抗原处理和呈递效率方面的显著差异。单变量Cox回归分析表明,APS与癌症患者的生存相关,有些具有统计学意义(图1B)。且具有泛癌风险比值的Meta分析表明APS与预后无关(图1B)。
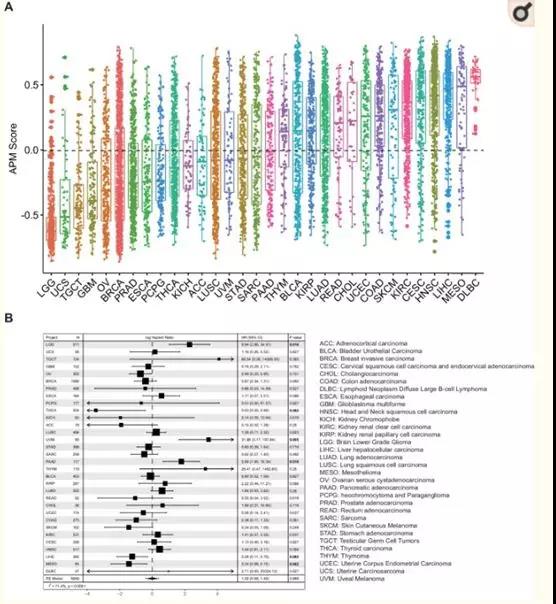
图1
②APS在癌症中的确定和相关性
为了识别决定患者APS状态的特定基因特征,作者首先根据APS状态对每种TCGA癌症类型进行差异基因表达分析。中位数以上为APS高,中位数以下为APS低。差异表达基因(p-value < 0.01, FDR < 0.05)由logFC从高到低排序,然后选择MSigDB的基因集进行基因集富集分析(GSEA)。在hallmark基因组的结果中,发现几个基因特征(特别是干扰素/伽玛反应)在大部分APS水平高的TCGA癌症类型中富集,表明APS水平高与干扰素/伽玛信号通路密切相关(图2A)。GSEA进一步验证了这一结果(图2)。并且,干扰素伽玛被报道调节APM基因表达,这与这一观察是一致的。此外,免疫细胞浸润评分(Immune score, IIS)通过GSVA计算,使用免疫细胞类型的标记基因列表,并通过CIBERSORT方法验证。TIMER是另一种可以根据复杂组织的基因表达谱,准确分辨不同细胞类型相对分数的方法。为了进一步验证计算出的IIS,作者进行了TIMER分析,发现TIMER结果与计算出的IIS高度相关(图2)。也观察到APS和IIS在癌症类型水平和患者个体水平上的显著相关性(图2 B和C)。TMB与IIS的相关性较弱(图2D和E)。
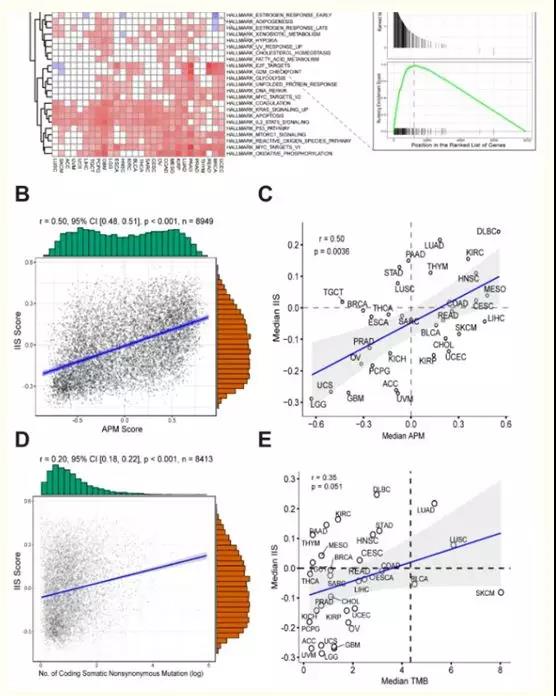
图2
③肿瘤免疫原性评分定义和泛癌分析
肿瘤免疫原性由两个因素决定:肿瘤细胞的抗原性和肿瘤抗原的加工和表达。这两个因素是独立的,都是肿瘤免疫原性测定所必需的。从理论上讲,肿瘤免疫原性评分(TIGS)可以表示为[肿瘤抗原性]x[抗原处理及呈递状态]。首先作者计算了TMB和RNA-seq基因表达数据均可获得的TCGA样本的TIGS(32种癌症类型,8413个样本)(图3A)。高TIGS的癌症类型包括:皮肤黑色素瘤(SKCM)、弥漫性大b细胞淋巴瘤(DLBC)、结肠腺癌(COAD)、头颈部鳞癌(HNSC)(图3A)。单变量Cox回归分析表明,TIGS与癌症患者的生存相关,这种相关性在某些癌症类型中具有统计学意义(图3B)。涉及所有TCGA癌症类型的Meta分析表明,在未接受免疫治疗的患者中,高TIGS往往与不良预后相关(图3B),这可能是由于其机制与导致高TMB的机制相同。
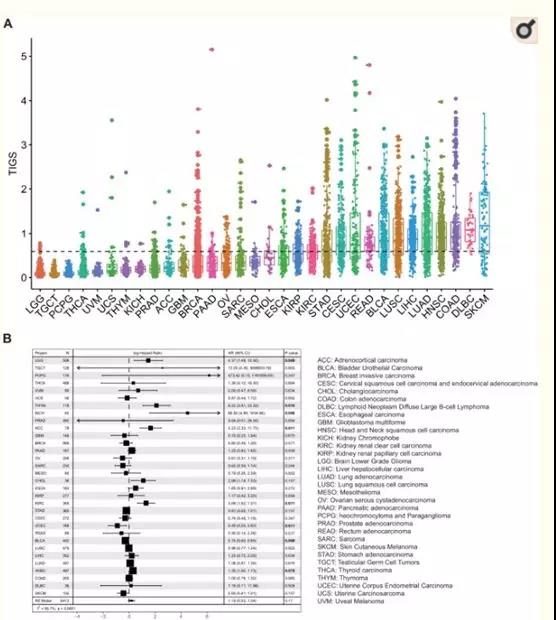
图3
④TIGS与泛癌ORR对PD-1的抑制作用
计算TIGS,可以使用两种不同的方法。在第一种方法中,APS和TMB信息来自于不同的研究。这种方法可以包含大量不同的癌症数据集。在第二种方法中,所有的APS和TMB信息都是从相同的TCGA数据集中获得的,在这种情况下,可用于研究的癌症类型少。在TCGA数据集的基础上计算23种肿瘤类型的APS信息,在GEO芯片数据集上计算默克尔细胞癌、皮肤鳞癌和小细胞肺癌的APS信息。发现APS、TMB、TIGS与ORR显著相关(图4)。这些泛癌的ORR分析表明,TIGS在与免疫治疗ORR的相关性方面优于TMB或APS。当使用第二种方法进行TIGS计算时,TIGS在泛癌ORR相关性方面仍然优于TMB和APS。

图4
⑤TIGS与ICI临床反应的预测
与TMB和APS相比,TIGS在不同类型癌症中与免疫治疗ORR的相关性增强。在此,作者进一步评估TIGS在预测单个癌症患者ICI临床反应中的表现,作者使用ROC曲线来观察在TMB、TIDE或TIGS值的不同阈值下真实阳性率与假阳性率(图5A-C)。与广泛使用的ICI-response 标志物TMB相比,TIGS在所有三个ICI数据集上都取得了更好的性能(图5A-C)。TIGS的预测能力可与两组黑色素瘤数据集中的TIDE相媲美。然而,TIDE未能预测尿路上皮癌对免疫治疗的反应,因此TIGS在尿路上皮癌数据集中表现更好(图5C)。TIGS在三个数据集中也优于其他基于基因表达谱的免疫治疗生物标志物,包括IIS、IFNG、ISG、RS, IFNG等(图5D-F)。此外,APS本身也显示了更优或类似的预测能力相比其他生物标记(图5D-F)。在所有三个可用的数据集中,Kaplan Meier进一步比较了高低TIDE、TMB或TIGS水平患者的总体生存曲线(图5G O)。

图5
4.结论
文章在泛癌中使用表达数据、临床数据以及结合免疫评估,差异表达,GSEA,生存分析等方法最终识别出了有效的生物学标志物,并对标志物的性能进行了测评,工作量很大。无论是研究预后还是免疫的小伙伴都可以借鉴文章的研究方法以及角度。
如涉及知识产权请与我司联系
|