来源:医药魔方
近年来,通过招募人体免疫细胞来破坏肿瘤组织的免疫疗法给癌症治疗带来了很大希望。一种能激活免疫细胞表面CD40受体从而刺激自然杀伤性T细胞产生的抗体在临床前研究中显示出强大潜力。然而,在随后的临床试验中,CD40抗体的成功率远低于预期,只有不到20%的患者产生应答。
知识卡:CD40是肿瘤坏死因子(TNF)受体超家族成员,主要在抗原呈递细胞(APCs)上表达,包括树突状细胞、B细胞、巨噬细胞、单核细胞和癌细胞亚群等。CD40与CD40L(CD154)的结合可直接激活APCs,这涉及共刺激和主要组织相容性复合体(MHC)分子的上调以及促炎细胞因子的产生,是产生抗肿瘤免疫应答的关键步骤。
近日,巴塞尔大学的癌症免疫学研究小组证明,抗CD40抗体与另外两种抗血管生成抗体结合,可以显著提高其抗癌效果。对当前免疫治疗无应答的患者可能从这种新疗法中获益最多。相关研究成果于2019年12月30日发表在 PNAS 上[1]。

图片来源:PNAS [1]
这项研究的出发点是观察到抗CD40抗体的使用会导致杀伤性T细胞的增加,但这些细胞只能在肿瘤的外围而非内部被检测到。研究人员怀疑这是由于肿瘤血管的性质导致的。
“正常情况下,肿瘤血管会渗漏或发育不良,这限制了杀伤性T细胞进入肿瘤内部。我们的假设是,只有具备足够的健康血管,杀伤细胞才能侵入并摧毁肿瘤。” 文章的第一作者 Abhishek S. Kashyap 博士解释道。
因此,他们将抗CD40抗体与另外两种能够稳定肿瘤血管的抗血管生成抗体——抗血管内皮生长因子A(VEGFA)和血管生成素2(Ang2)抗体结合起来。其中一种名为Avastin的抗血管生成抗体已经被批准用于癌症治疗,而另一种仍在临床开发中。所有抗体均由罗氏公司提供。
知识卡:一些促血管生成生长因子(主要是VEGFA)会限制树突状细胞成熟,促进肿瘤中免疫抑制的未成熟髓细胞的积聚。因此,阻断促血管生成生长因子不仅可以抑制血管生成,而且可以减轻肿瘤的免疫抑制。几种阻断VEGFA信号传导的抗血管生成疗法经过了临床前和临床测试。然而,抗VEGFA疗法与标准护理疗法相结合,根据癌症类型,仅将无进展生存期增加3–6个月,总生存率略有提高(如果有的话)。
随后,研究人员在几种不同类型的癌症(结直肠癌、乳腺癌和黑色素瘤)小鼠模型中测试了这种新的抗体组合。正如预期的那样,这3种抗体的组合(抗VEGFA/Ang2/CD40抗体)能显著提高所有癌症小鼠模型的抗肿瘤活性并延长生存期。
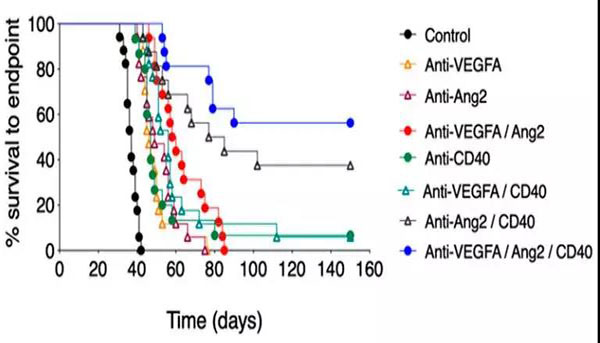
结直肠癌模型小鼠的 Kaplan-Meier 生存曲线图。图片来源:PNAS [1]
进一步的研究分析揭示了这种成功背后的机制:未成熟血管的渗漏增加和灌注减少可能会削弱肿瘤内药物传递和免疫细胞运输。而VEGFA和Ang2双重抑制可诱导不同小鼠肿瘤模型中的血管“修剪”(pruning)和残余血管正常化,显著降低无功能血管的比例,提高血管成熟度,改善肿瘤应答性T细胞的运输。这表现在抗CD40单药治疗后,CD8+T细胞主要定位于肿瘤外围,而当其与抗VEGFA/Ang2联用时,CD8+T细胞向肿瘤核心的浸润增强。
此外,研究还表明,基于抗CD40的抗血管生成免疫治疗组合能促进免疫刺激性和促炎性肿瘤微环境的生成。表现为小鼠乳腺肿瘤模型(MMTV-PyMT)中,3种抗体组合治疗组的炎症细胞因子(IL-1β、IL12、IL6、IFNg)和T细胞招募趋化因子(CXCL9、CXCL10)的增长倍数最高。
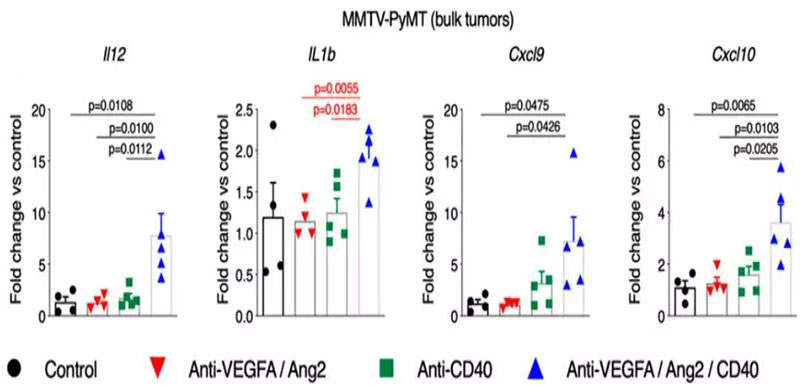
治疗后第5天MMTV-PyMT小鼠全肿瘤裂解液中Il12、Il1b、Cxcl9和Cxcl10的qPCR分析。图片来源:PNAS [1]
Kashyap认为,对免疫治疗应答不良的“冷”肿瘤患者,可以从这种新的组合治疗中获得最大收益。抗血管生成抗体可能会使“冷”肿瘤变“热”,从而使免疫治疗效果更好。
他还表示,这项研究的优势不仅在于所获得的良好结果,还在于几个不同的实验室取得了相同的结果。
总结来说,该研究证明CD40激活联合VEGFA/Ang2双阻断可提高CD8+T细胞浸润,并通过诱导非冗余但协同的免疫和血管调节机制实现肿瘤根除。
如涉及知识产权请与我司联系
|