2025年2月21日,浙江时迈药业有限公司自主研发的I类治疗用生物制品注射用CMD011获得FDA默示许可,本品为全人源抗GPC3×CD3双特异性抗体,拟用于晚期肝细胞癌治疗。此为全球第三个获得FDA临床试验批准的GPC3×CD3双特异性抗体。 关于CMD011 CMD011是时迈药业基于自主开发的抗体筛选文库和完全自主知识产权的双抗平台构建的肿瘤细胞靶点+免疫细胞靶点组合的全人源双抗药物。 目前肝癌治疗存在临床未满足需求,比如小分子靶向药物快速产生耐药性,PD1类药物疗效不佳。GPC3特异性表达于肝细胞癌上,在正常组织中几乎不表达,是较为适合GPC3×CD3双特异性抗体开发的靶标。CMD011具有明确的抗肿瘤机制,通过共结合GPC3阳性肿瘤细胞和CD3阳性T细胞诱导T细胞活化并杀伤肿瘤细胞。它的设计基于时迈药业自主研发的HBiTE双抗平台,优化了对GPC3和CD3的亲和力,从而实现更高的肿瘤选择性和更低的毒副作用。 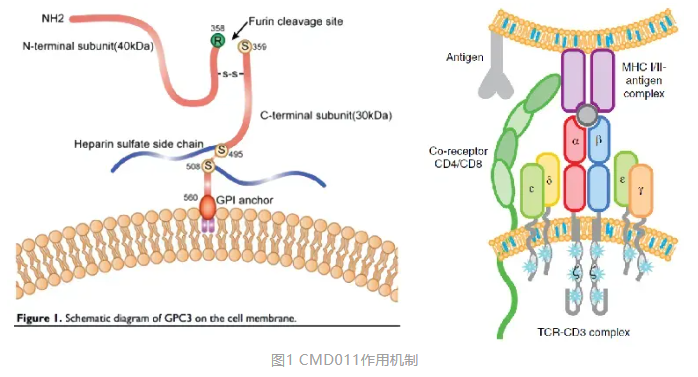
CMD011潜在优势与特点 现阶段靶向GPC3的主要研究方向包括CD3型双抗、CAR-T等疗法,同时也有单克隆抗体和其他新型免疫疗法的研发。在这些研究中,CMD011具有以下潜在优势与特点: CMD011基于时迈拥有自主知识产权的HBiTE平台的独特设计避免了由同源二聚体导致的T细胞过度激活毒副作用,能够在保持高效抗肿瘤活性的同时降低非特异性毒性。 CMD011基于时迈HBiTE平台,特殊结构增强肿瘤靶向性,大幅拓展治疗窗口,工艺开发简单,稳定性好,不依赖个体化制备,适合大规模生产,成本较低。成本优势使其有望成为一种更具普惠性的治疗选择。 基于CD3双抗的CMD011相对CAR-T作用更加温和,联合治疗的潜力更大,在联合治疗中的应用前景更广阔,可为肝癌患者提供更多个性化治疗方案。 CMD011可通过静脉注射给药,使用方便,适合门诊或长期治疗。 总结 目前,GPC3靶向双抗的研发仍处于早期阶段,随着双抗技术的不断进步,未来可能会有更多的公司加入到GPC3靶向双抗的研发中,将为肝癌患者带来更多的治疗选择和临床收益。 时迈药业 CMD011获批FDA,完成中美IND双报,进一步验证了时迈药业自身技术平台与研发能力,增强了技术平台国际化背书和数据互认,推动了项目全球多中心临床试验进程,加速国际化布局和药物全球化开发进程,通过资源整合、风险分散和资本运作,显著提升项目的临床和商业价值,进一步巩固时迈药业CMD011全球领先地位。 |