治疗性单克隆抗体已经成为目前最有效的生物治疗剂之一,大多数批准的单克隆抗体疗法属于人IgG1亚类,其可以参与免疫系统的体液免疫和细胞免疫。体液免疫的参与主要取决于补体与C1q的相互作用启动的一系列蛋白水解级联反应,细胞免疫应答主要是由于抗体Fc与Fcγ受体(FcγRs)之间的相互作用产生(图1)。单克隆抗体的疗法的成功基于其安全性、选择性、多样性、溶解性、耐受性和稳定性和长循环半衰期。尽管许多基于抗体的疗法已经在临床和商业上取得了成功,但基于抗体的疗法通常仅在一部分患者中有效,因此,为了在更大的患者群体中实现功效,研究人员已经进行了相当大的努力来微调抗体的性质。其中一个重点领域是通过Fc工程调节抗体与免疫系统的体液和细胞组分相互作用的能力。在这里,我们简单介绍下通过抗体Fc工程来提高同种型IgG的功效和安全性。

图1. 人类细胞亚群中Fc-FcγR相互作用亲和力和FcγR表达
Enhance CDC
几种已批准的抗体已经证明具有有效的体外CDC活性,例如抗CD20单克隆抗体rituximab(利妥昔单抗)和atumumab。研究人员利用Fc工程来增强补体的效应功能的方法有很多种(图2)。 Idusogie等证明K326W/E333S相对于IgG1增强了C1q结合和CDC活性,猜测这两个残基在C1q和IgG之间的相互作用中起结构作用。Moore等人证明Fc突变S267E/H268F/S324T比IgG1增强C1q结合47倍和CDC活性6.9倍。推测S267E突变体改变了Fc的电荷,可能增加与C1q亚基B的离子间相互作用。在四种人IgG亚类中,IgG3具有最有效的CDC活性,然而,由于IgG3的相对较短的半衰期以及与IgG3的长铰链区相关的生物加工问题,目前还没有批准的IgG3治疗剂。为了克服与IgG3的相关问题,Natsume等人设计了交叉IgG亚类变体,其将IgG1的CH1和铰链区与IgG3的CH2和CH3区组合,使其相对于IgG1高达50倍的CDC活性。这种增强的活性可归因于CH2区域中IgG1和IgG3之间的差异(即K274Q/N276K/Y300F),其在结构上接近被认为是C1q相互作用的关键氨基酸D270/K322/P329/P331的位置处。 Diebolder等采用突变E345R/E430G/S440Y改造Fc区,产生预先形成的IgG六聚体和增强的CDC活性。结构数据表明,六聚体将K322定位在能够有利地与六聚体C1q头部相互作用的位置。

图2. Enhance CDC 总结
FcγR-based 工程化增强效应功能
mAb的功效部分依赖于募集基于FcγR的效应子功能。这包括通过FcγRIIIa激活NK细胞和由此产生的ADCC和炎性细胞因子释放,巨噬细胞介导的ADCP,以及其他免疫细胞(例如嗜中性粒细胞)的募集和活化。对于NK细胞介导的ADCC的关键受体FcγRIIIa,存在两种多态性变体:对IgG1具有较高亲和力的V158和对IgG1具有较低亲和力的F158。在一些临床试验中报道了这些多态性的潜在重要性,其中具有高亲和力V158多态性的癌症患者与具有低亲和力F158多态性的患者相比,显示出来自西妥昔单抗,曲妥珠单抗和利妥昔单抗更好的治疗效果。由于增强与FcγR的结合和由此产生的增强的先天免疫细胞功能的潜在益处,研究人员已经利用多种方法来设计mAb,包括糖工程和Fc区内的氨基酸突变。
a)Glyco-engineering
IgG在CH2结构域的氨基酸N297处含有保守的糖基化位点,聚糖的核心结构由N-乙酰葡糖胺(GlcNAc)和甘露糖组成,其中另外的修饰可包括二等分GlcNAc,岩藻糖,半乳糖和唾液酸。 Umana等证明,在表达b(1,4)-N-乙酰葡糖胺基转移酶III的中国仓鼠卵巢(CHO)细胞系中产生的IgG1抗体相对于IgG1具有增强的ADCC活性。 Shields等人的一项研究表明岩藻糖缺乏的IgG1相对于IgG1具有高达50倍的FcγRIIIa结合增强以及ADCC增强活性。目前,已经批准了糖工程化抗体,如抗CD20 mAb-obinutuzumab和抗CCR4 mAb-mogamulizumab,证明用于增强效应功能的糖工程可以转化为临床批准的治疗剂。
b)氨基酸突变
研究人员通过了IgG Fc区的氨基酸突变来调节与FcγR的效应子功能。包括点突变、设计算法、酵母展示和不对称工程等方法(图3)。

图3. FcγR-based 工程化增强效应功能总结
Shields等对人IgG1的CH2和CH3结构域中所有溶剂暴露的氨基酸进行单个丙氨酸点突变。证明组合几种鉴定的突变(例如,S298A/E333A/K334A)导致相对于IgG1增强的ADCC。Lazar等人使用通过设计算法和高通量筛选,设计了一系列Fcγ受体高亲和力的Fc变体。S239D/I332E和S239D/I332E/A330L被鉴定为具有增强的ADCC活性的两种变体。解析S239D/A330L/I332E的Fc突变片段的晶体结构,表明额外的氢键,疏水接触和静电相互作用是导致与FcγRIIIa结合增强主要原因。Richards证明,在S239D/I332E突变中加入G236A突变可使FcγRIIa的结合提高70倍,FcγRIIa/FcγRIIb结合率(活化/抑制率)提高13倍,并增强抗体介导的吞噬作用(ADCP)。Stavenhagen等利用酵母表面展示鉴定突变体F243L/R292P/Y300L/V305I/P396L,其显示ADCC活性增加>100倍。具有这5种突变的抗HER2 mAb-margetuximab完成了HER2阳性晚期乳腺癌患者的III期临床试验,作为三线、四线药物比赫赛汀本身显著延长PFS、降低24%进展风险。Mimoto等人通过在每个Fc结构域中引入不同的氨基酸变化,设计具有不对称工程Fc结构域的抗体变体。他们筛选了约1000种变体,证明在一条重链L234Y/L235Q/G236W/S239M/H268D/D270E/S298A突变,在另一条重链进行D270E/K326D/A330M/K334E突变可以增加在FcγRIIIaF158的的亲和力超过2000倍,在 FcγRIIIaV158亲和力超过1000倍。
FcγR-based 工程化降低或消除效应功能
对于mAb与细胞表面受体结合并阻止受体-配体相互作用(即拮抗剂)的情况,可能需要降低或消除效应功能,例如通过减少这种非预期的效应功能以防止靶细胞死亡或不需要的细胞因子分泌。研究人员设计生成了人IgG4变体L235E或F234A/L235A,以及人IgG1变体L234A/L235A等,所有这些都证明减少了炎性细胞因子的释放。另一种旨在降低效应功能的早期方法是突变糖基化位点,例如N297A、N297Q和N297G。已经证明这种糖基化方法成功地消除了Fc了与FcγR的相互作用和效应功能(CDC和ADCC)。
在四种IgG亚类中,每种具有引发免疫效应功能的不同能力。例如IgG1和IgG3比IgG2和IgG4更有效地募集补体,另外,IgG2和IgG4具有非常有限的ADCC的能力。因此,一些研究者采用跨亚型的方法来减少效应功能(图4)。批准的抗C5治疗剂eculizumab具有118-260的IgG2氨基酸和264-447的IgG4氨基酸,并且已显示具有有限或不可检测的效应功能,因此,eculizumab代表了第一个概念验证。在跨亚型方法的进一步改进中,An等人改造了具有来自IgG4的点突变的IgG2变体(即,H268Q/V309L/A330S/P331S),该变体具有减弱的效应功能以及在恒河猴中与IgG1相当的半衰期,在类似的方法中,Vafa报道了一种变体,其含有IgG2至IgG4的跨亚类突变V309L/A330S/P331S与非种系突变V234A/G237A/P238S/H268A,导致检测不到CDC,ADCC和ADCP作用。

图4. FcγR-based 工程化降低或消除效应功能总结
FcRn 工程化调节mAb半衰期
新生儿Fc受体(FcRn)是一种MH1Like异二聚体,在细胞运输和IgG的血清半衰期中发挥核心作用,抗体的长循环半衰期(7-21天取决于IgG亚类)在很大程度上归因于它们与FcRn结合的能力。
FcRn主要在核内体中表达,它能够通过胞饮作用内化IgG。IgG的CH2-CH3结构域中保守的组氨酸残基在酸性内体pH(6.0-6.5)下质子化,驱动pH依赖性结合FcRn的α-链,随后在生理pH(7.4)下将IgG再循环并释放到血液中,从而避免在溶酶体降解。Fc区与FcRn上的关键接触位置包括L251、M252Y(Fc突变之一)、I253、L309、H310、L314、Q311和N434,研究证实H310的强氢键是pH依赖性结合的关键,该氨基酸突变为任何其他氨基酸(不包括半胱氨酸)则在pH6.0下不能检测到与FcRn的结合。FcRn介导的抗体再循环机制引起了治疗性抗体的药代动力学(PK)的兴趣。目前研究人员已经在CH2-CH3处设计了突变,目的是延长抗体的血清半衰期进而可以通过降低治疗剂量和给药频率以降低成本而使患者受益(图5)。噬菌体展示Fc变体文库的筛选鉴定了在pH6.0下具有增强的与人FcRn的结合的突变体YTE(M252Y/S254T/T256E)。YTE变体与人和食蟹猴FcRn的结合能力增加了10倍,在食蟹猴PK研究中半衰期增加了4倍。Zalesky等人表明突变M428L/N434S在pH6.0下对人FcRn的亲和力增加11倍。当用含有M428L/N434S突变的抗VEGF抗体处理人FcRn转基因荷瘤小鼠时,与IgG1处理的动物相比,观察到更好的抗肿瘤效果。这是FcRn依赖性半衰期增加导致的改善的抗肿瘤活性的第一个体内证明。Motavizumab-YTE是一种靶向呼吸道合胞病毒的人源化抗体,是第一种针对FcRn介导的半衰期延长而设计的抗体,已在人类受试者中进行测试,I期临床试验结果显示,相对于motavizumab IgG1,其半衰期增加2至4倍。
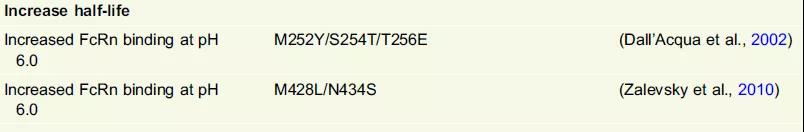
图5. FcRn 工程化增加mAb半衰期总结
参考文献
[1]. Wang, X., Mathieu, M., Brezski, R.J. IgG Fc engineering to modulate antibody effector functions[J]. Protein Cell, Jan, 2018, 9 (1): 63-73. [主要参考文献]
[2] Barnhart, B.C., Quigley, M. Role of Fc-FcgammaR interactions in the antitumor activity of therapeutic antibodies[J]. Immunol Cell Biol, Apr, 2017, 95 (4): 340-346.
[3]. Hogarth, P.M., Pietersz, G.A. Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond[J]. Nat Rev Drug Discov, Mar 30, 2012, 11 (4): 311-31.
[4]. Nimmerjahn, F., Gordan, S., Lux, A. FcgammaR dependent mechanisms of cytotoxic, agonistic, and neutralizing antibody activities[J]. Trends Immunol, Jun, 2015, 36 (6): 325-36.
如涉及知识产权,请与我司联系!
|