来源:癌图腾 基因改造后结合癌细胞抗原并激活T细胞杀死癌细胞的双特异性抗体显示出临床前景。不幸的是,由于不受控制的免疫激活和细胞因子释放,它们也可能引起严重的毒副作用。 无论采用哪种方式,T细胞激活疗法通常都会伴随全身性细胞因子释放,这可能会进展为致命性的细胞因子释放综合征(CRS),即细胞因子风暴。鉴于在机制上对T细胞激活和全身性细胞因子释放之间的关系的不完全理解,人们尚不清楚如何实现保留全部治疗潜力的最佳毒性管理。 在一项新的研究中,来自美国基因泰克公司的研究人员报道了将CD3双特异性抗体介导的杀伤与毒性细胞因子释放相关联在一起的细胞类型特异性的细胞机制。这种免疫级联反应是由T细胞触发引起的,然而单核细胞和巨噬细胞是全身毒性细胞因子释放的主要来源。他们证实T细胞产生的肿瘤坏死因子α(TNF-α)是CD3双特异性抗体治疗后介导单核细胞激活和全身性细胞因子释放的主要机制。相关研究结果发表在2019年9月4日的Science Translational Medicine期刊上,论文标题为“CD3 bispecific antibody–induced cytokine release is dispensable for cytotoxic T cell activity”。 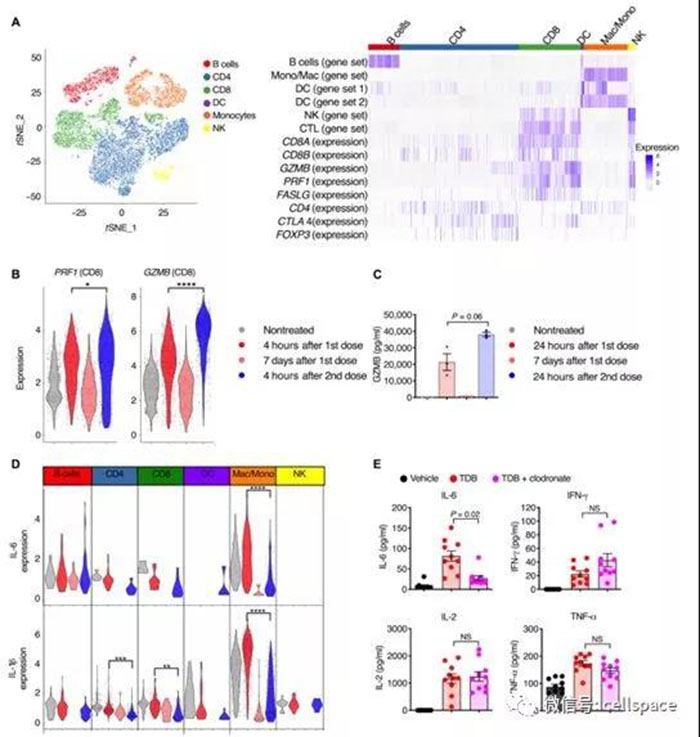
图片来自Science Translational Medicine, 2019, doi:10.1126/scitranslmed.aax8861。 阻止TNF-α释放足以在不影响抗肿瘤效果的同时破坏单核细胞细胞因子的全身性释放。仅在最初暴露于CD3双特异性抗体时才观察到全身性细胞因子释放,而在后续的CD3双特异性抗体剂量暴露中则观察不到,这表明剂量之间存在生物学差异。 尽管第二次暴露后细胞因子释放受损,但T细胞的细胞毒性仍然不受影响,这表明在不释放细胞因子的情况下可以实现T细胞的细胞溶解活性。在CD3双特异性抗体存在的情形下,毒性细胞因子与T细胞的细胞溶解活性在机制上的解偶联为临床上探索减轻毒性的预防性治疗方法提供了生物学依据。 CAR-T细胞免疫疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。这种新的治疗策略的关键之处在于构建一种被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体来特异性地识别在癌细胞表面上表达的抗原,如B细胞恶性肿瘤的CD19、CD20和CD22,胶质母细胞瘤的EGFRRVIII。它在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。近年来,CAR-T细胞免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也有望用来治疗实体瘤、自身免疫疾病、HIV感染和移植排斥等疾病,具有更广阔的应用空间。 然而,CAR-T细胞免疫疗法尽管在治疗血液肿瘤中有巨大的希望,但是同时也存在较大的副作用。CAR-T细胞免疫疗法带来一个巨大的临床风险就是细胞因子释放综合征。当CAR-T细胞快速杀死癌细胞时,产生的大量细胞因子会对宿主其他组织器官发起惊人的攻击,导致高烧、低压、休克甚至死亡。 这项新的研究为在未来通过进一步改进CAR-T细胞免疫疗法降低细胞因子释放综合征同时确保它的抗肿瘤免疫反应不受影响奠定了基础。 如涉及知识产权请与我司联系
参考资料:Ji Li et al. CD3 bispecific antibody–induced cytokine release is dispensable for cytotoxic T cell activity. Science Translational Medicine, 2019, doi:10.1126/scitranslmed.aax8861. |