来源:医药时间 今日,据 CDE 官网显示,4 款 1 类新药获临床试验默示许可,正式进入临床。
时迈药业:注射用DNV3 据时迈官网显示:DNV3 是新一代免疫检查点抑制剂,靶向多种实体瘤,用于临床多种组合治疗,此次申报适应症为:晚期/转移性实体瘤和淋巴瘤。这也是时迈第一款进入临床的产品。 DNV3是第四款国产LAG-3抗体,此前,信达生物、维立志博、恒瑞医药先后申报LAG-3抗体,此外,再鼎医药从Macrogenics引进了PD-1/LAG-3双抗也已经申报临床。 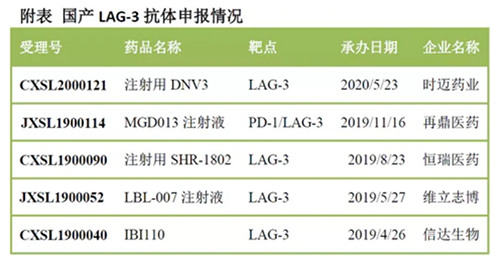
时迈药业开发了基于单链mFc的双抗技术平台,佰傲谷评价:时迈药业的双抗技术颇具想象力,一般双抗多基于重链CH3进行设计,时迈药业反其道而行之,去除CH3的相互作用形成单链形式。CH1、CL本来分别连轻重链可变区,时迈药业用其分别连两个scFv,达到双特异性的设计。
祐和医药:重组抗CTLA-4人源化单克隆抗体注射液 适应症为局部晚期或转移性实体瘤。 全球范围内上市的靶向CTLA-4 的单克隆抗体药品有 Bristol-Myers Squibb的 Ipilimumab(伊匹木单抗,商品名:Yervoy ),2011年3月25日经FDA批准上市,Ipilimumab 是全人、具有κ轻链的抗 CTLA-4 的 IgG1 型单克隆抗体。 CTLA-4 主要表达在调节性T细胞(Treg)和活化的 T 细胞上,通过与 CD28 竞争抗原呈递细胞上的 B7 配体 (B7-1和B7-2),从而抑制 T 细胞的增殖和细胞因子(IL-2 和IFN-γ)产生。CTLA-4 单抗则通过上调人体效应性 T 细胞介导的抗肿瘤免疫反应和弱化调节性T细胞介导的免疫抑制活性,来抑制肿瘤细胞的免疫逃逸,提高机体自身针对肿瘤细胞的免疫应答,从而达到治疗多种肿瘤的目的。 中国大陆尚无同靶点的同类药物上市。根据IQVIA MIDAS资料,2019年度,Ipilimumab 全球销售额约为 15.23 亿美元。 国内在研CTLA-4 单抗中,复宏汉霖的 HLX13 于 2020 年 4 月获批临床,为 Ipilimumab 的生物类似物,用于无法切除或转移性黑色素瘤、晚期肾细胞癌、微卫星高度不稳定或错配修复缺陷的转移性结直肠癌治疗以及黑色素瘤的辅助治疗。 
另外,双鹭药业的重组全人抗 CTLA-4 单克隆抗体注射液也已进入临床,主要用于晚期黑色素瘤的治疗。 信达生物的 IBI310 目前处于 1 期临床,在研适应症包括:肝癌、肾细胞癌等。 再有华兰生物的 “CTLA-4 单抗”,在2018年5月,其临床试验申请获国家药监局受理。
康方生物:AK112注射液 康方药业的 AK112 注射液为靶向 PD-1/VEGF 的双特异抗体新药,2019 年 7 月 1 日,AK112 获得美国 FDA 颁发的药物临床试验(IND)批件。AK112 是新一代的抗肿瘤免疫治疗药物,是康方生物利用康方独特的Tetrabody双抗平台、自主研发的双抗产品。 抗血管生成药物和免疫治疗药物联合使用,可在一定时间内重塑肿瘤生长的微环境,使其变成免疫治疗友好型环境。PD-1抗体和抗血管生成药物可以产生协同抗肿瘤作用。多项临床研究显示,在一些PD-1单药治疗效果不是很理想的瘤种,包括肝癌、胃癌、和微卫星稳定的结直肠癌等,PD-1抗体和抗血管生成药物联用都取得了令人鼓舞的进展。PD-1和VEGF在肿瘤微环境同时富集,相对于联合用药,更有利于双特异抗体药物药效和安全性。
瑞博生物:ISIS 560131注射液 用于治疗雄激素受体剪接变异体7(AR-V7)阳性的转移性去势抵抗性前列腺癌。 如涉及知识产权请与我司联系
|