来源:细胞王国 癌症的发生从来就不是一朝一夕的事。 从历史的角度看,癌症伴随人类进化了上千年。科学家们在古埃及木乃伊中就已发现了癌症存在的证据。这一张牙舞爪的魔鬼伸出长长的触手,把死亡的恐怖散播到全身各处。Cancer,另一个意思是螃蟹,恰好来源于古希腊人对于这一病症的形象描述。而可以肯定的是,癌症的阴霾至少还将萦绕在人类头顶半个世纪。 现代医学最先进的成像仪器也难以检测到1mm大小的肿瘤,但这么小的肿瘤已经包含了一百万个癌细胞。当肿瘤长大到1cm时,也就是增强CT扫描图像中的一个小结节,肿瘤内的癌细胞已经多达十亿个。 假设肿瘤完全不受控制地增长,每2天就能翻一倍(事实上许多癌细胞系在体外培养的速度比这还要快,几乎每天翻一倍),那么一个癌细胞只需要不到半年就能取代身体所有的细胞。事实上癌细胞总质量达到1kg时其消耗的能量和代谢废物足以杀死一个成年人。然而从一个癌细胞生长到现代医学可以检查出来的肿瘤,往往需要5-10年时间。一方面,癌细胞并不是生来就“恶”的,它需要积累足够多的基因突变完成量变到质变的过程;另一方面,癌症的发生需要逃过身体免疫细胞的重重关卡。 早在1909年,德国科学家Paul Ehrlich就提出了最初的癌症免疫假说:在生长发育过程中难免会产生异常细胞,但鲜有人因此罹患癌症,这一切都归功于免疫系统系统的保护。但受限于当时的技术水平和认知,该假说并不能用实验手段验证。30年后,美国科学家Lewis Thomas提出,免疫系统通过识别肿瘤特异抗原来清除体内的癌细胞,即所谓的免疫监视理论(immune surveillance theory)。1953年,Frank MacFarlane Burnet通过异体移植模型初步证明了他的猜想:将致癌物诱导产生的肿瘤移植到同一品系的小鼠身上,会马上被排斥;而正常组织移植则不会。 随后,对T细胞、NK细胞、抗原呈递细胞功能的深入研究补充了免疫监视理论的细节。2002年,Robert Schreiber等人提出免疫编辑(immunoediting)理论,进一步完善了肿瘤免疫的框架。在他的理论中,肿瘤的发展需要经过三个免疫阶段:
1. 消除(elimination):初期癌细胞很容易被NK、T细胞杀死; 2. 平衡(equilibrium):肿瘤积累一定突变后,能抵抗胞毒性细胞的追杀,与免疫细胞平起平坐; 3. 逃逸(escape):继续发生突变,解除免疫细胞对肿瘤的生长抑制,开始形成临床可检测的肿瘤。肿瘤的生长类似于物种进化,在免疫系统的选择压力下,只有能成功逃脱免疫反应、拥有强大生存能力的肿瘤细胞才能幸存下来。 J Clin Invest. 2007;117(5):1137-1146. https://doi.org/10.1172/JCI31405.
与外源性病原体不同,癌细胞来源于正常细胞,表达正常细胞表达的几乎所有蛋白,因此更难被免疫系统区分。细菌、病毒靠着强大的进化能力一次次逃过了免疫细胞的火眼金睛,同样癌细胞也能通过不断进化伪装自己。况且在免疫系统的军队里,不同类型的细胞发挥的功能截然不同,有些甚至会阻止友军杀敌。淋巴细胞里,B细胞在肿瘤面前基本是个瞎子(很难有可以被BCR识别的肿瘤抗原,而T细胞和NK细胞才是杀灭肿瘤的主力军。但并不是说B细胞对于抗肿瘤一点用都没有,除了分泌抗体以外,B细胞还可以作为抗原呈递细胞、分泌细胞因子,这些对于抗击肿瘤来说还是有巨大的帮助)髓系细胞里,同样是抗原呈递细胞,树突状细胞出现在肿瘤里的频率往往和好的预后相关,而巨噬细胞却往往和不良预后挂钩(尤其是M2型巨噬细胞)。 同样包括在猪队友名单里的还有中性粒细胞以及调节性T细胞(Treg),甚至还有不属于免疫系统的成纤维细胞(观战者)。目前这些细胞在肿瘤中的具体作用和分子机制还没有彻底研究清楚,留在我们面前的还是一个大黑箱。 而利用免疫系统来治疗癌症,早在理论横空出世前就被应用到了临床。1891年,美国医生William Coley意外发现术后化脓性链球菌感染能使肉瘤患者肿瘤消退,并将其运用于治疗骨癌和软组织肉瘤。这一发现打开了癌症免疫治疗的先河。然而在那个时代,免疫系统对于科学家来说还是一个黑箱子,且在抗生素被发现之前,对于人类最大的威胁并不是癌症,而是细菌、病毒引发的传染病。1946年起,随着二战结束,美国癌症协会(ACS, American Cancer Society)累计拿出36亿美元支持癌症研究。在抗生素有力控制了细菌感染后,癌症开始受到更多国民的关注。化疗、放射线疗法等更强力有效的治疗手段出现使科学家暂时搁置了不那么成熟有效的免疫疗法。 上世纪70年代,美国总统尼克松颁布法案支持国立癌症中心(NCI, National Cancer Institute),并拨出1亿美元科研经费,这场被称为第二个登月计划的抗癌战争正式打响。美国医生/科学家Steven Rosenberg是该计划的收益者之一。1968年,他偶遇了一位癌症晚期自愈的病例,从此醉心于癌症免疫研究一发不可收拾。1974年起,他开始尝试一种叫做过继性细胞输入(adoptive cell transfer,ACT)疗法。简单地说,就是从患者体内分离T细胞,经过体外扩增培养,再输回患者体内。他们发现一种叫IL-2的细胞因子可以刺激T细胞增殖,并在病人身上注射IL-2。不幸地是,IL-2激活免疫反应的能力使得许多病人产生了强烈副作用,且在前66位病人中均没有控制住肿瘤疯涨。奇迹终于在第67号病人上出现了:在接受了T细胞回输和IL-2联合治疗后,这位恶性黑色素瘤患者全身多处转移灶完全消失,并存活至今。这一成功大大鼓舞了癌症免疫学研究,因为它首次证实,仅通过靶向免疫系统而不靶向癌细胞,也可以治疗肿瘤。然而ACT仅能对极少数黑色素瘤和肾癌患者有效。
【参考:Coley toxin for treatment of sarcoma Adoptive Cell Transfer as Personalized Immunotherapy for Human Cancer】
另一个癌症免疫治疗的传奇故事则来源于以色列科学家Zelig Eshhar的一个脑洞。上世纪90年代,人们已经知道了T细胞受体(TCR),并初步了解了T细胞通过TCR识别MHC上的抗原肽锁定目标 的机制。Eshhar于是提问:能否将TCR的膜外区域改造成BCR,从而使T细胞识别天然状态的蛋白而不是经过蛋白酶消化呈递的肽段?嵌合抗原受体T细胞(Chimeric Antigen Receptor T cell, CAR-T)由此诞生。由于历史原因(1980年代HIV 被发现,因其无药可治在当时被称为超级癌症),最初设计CAR-T的初衷并不是用来治疗癌症,而是治疗艾滋病的。 在改造CAR-T功能上,美国科学家Carl June做出了很大贡献。随着何大一等人开发出鸡尾酒疗法,CAR-T这一繁琐的技术在治疗HIV上立刻显得相形见绌。机缘巧合下,June将目光转到了肿瘤上。许多肿瘤会表达正常组织不表达的肿瘤特异抗原(tumor-specific antigen),如果T细胞能识别它们,不就可以达到靶向杀死肿瘤的目的吗?CAR-T技术的诞生得益于日趋成熟的分子克隆和转基因技术,在此以前,要让淋巴细胞表达特定外源基因是一件极其困难的事。第一代CAR的胞外域和后续一样,都是单链抗体可变区融合蛋白scFv,用一条flexible linker连接单克隆抗体的轻重链可变区域(其实在最初科学家想用抗体的轻重两链,但发现这样表达效率极低);变化的是胞内区:第一代直接用CD3ζ(这是一个ITAM,即刺激下游T细胞激活的信号转导结构域),而随后的第二代、第三代CAR采用了多个共刺激结构域增强CAR-T的信号,使其拥有更高战斗力。 十五年后,针对CD19的第三代CAR-T细胞在治疗顽固性B细胞白血病的临床实验中大放异彩,CAR-T终于在癌症免疫疗法中奠定了一席之地。随后,可变的(switchable) CAR-T也开始亮相,科学家开始在胞外域上做文章:与其直接识别肿瘤抗原,不如在肿瘤抗原和T细胞嵌合受体上增加一个小把柄,只有加入这个特定的中间媒介才能让T细胞正常工作。这样就可以在不降低疗效的同时有效控制CAR-T防止过度激活引发的细胞因子风暴。 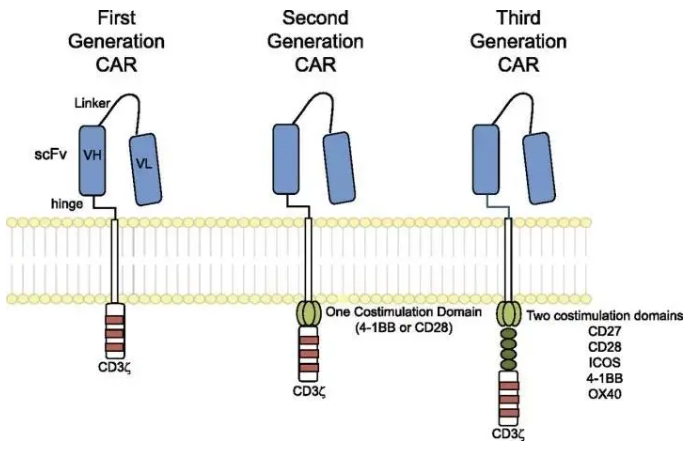

和CAR-T一样值得被载入史册的,当属2018年诺贝尔生理医学奖获奖研究——免疫检查点抑制剂与癌症治疗。免疫检查点的发现同样来源于过继性T细胞疗法中对T细胞功能的研究。当时已经发现B细胞、T细胞的激活不仅需要BCR/TCR,还依赖于共刺激信号分子,包括CD28家族的十多个成员,以及他们的配体,B7家族蛋白。抗原呈递细胞(APC)表面的共刺激分子决定了淋巴细胞的活化和抑制,这一功能有助于决定免疫系统何时出战何时停战,避免过度激活误伤无辜。 CTLA-4和PD-1是T细胞表面表达的两种重要共刺激信号分子,且均在 T细胞过度激活发生耗竭(exhaustion)前开始表达。CTLA-4的配体,B7-1和B7-2都只在专业的抗原呈递细胞上表达,而PD-1的配体PD-L1却在很多正常组织细胞上表达。肿瘤细胞发现了免疫系统的这个bug,它们也纷纷高表达PD-L1这个正常组织的“良民证”,非法逃避免疫系统追杀。堵住PD-1与PD-L1结合可以有效解除肿瘤细胞对T细胞的抑制作用。2014年,PD-1单克隆抗体Keytruda正式被美国药监局FDA批准,用于治疗转移性恶性黑色素瘤。次年,美国前总统Jimmy Carter使用该药物治疗晚期转移性黑色素瘤,取得了奇迹般的效果。和IL-2相比,PD-1/PD-L1单克隆抗体的副作用更小,对于某些肿瘤晚期患者的生存率有了极大提高,甚至能达到完全治愈的效果。 Costimulatory molecules as adjuvants for immunotherapy, Frontiers in Bioscience 11:788-803 (2006)
近年来,癌症免疫疗法成为继手术、化疗、放疗和靶向疗法后的又一大支柱,除了上文提及的ACT、CAR-T和免疫检查点抑制剂以外,天然免疫激活剂(如STING agonist、CpG等)、溶瘤病毒(如T-VEC)以及癌症个性化疫苗等靶向免疫细胞的新兴手段使得越来越多原本无可救药的患者看到了希望。然而必须承认的是,“道高一尺,魔高一丈”,我们只是在征服癌症的漫漫长路上迈出了很小的一步,却始终没有意识到:我们的对手,就是我们自己。癌症的梦魇原本就写在我们的基因里,而它的解,也许也藏在我们32亿碱基对中。 如涉及知识产权请与我司联系
|