来源:奇点糕 奇点网 发表时间:2019-2-13
2018年已经过去了一个多月了,这一年里医学世界迎来了一系列重大进展,解决了很多以前未能解决的问题,但也留下了一些疑惑。
奇点君在这里总结了个人的2018年度十问,希望读者们能够跟着我们一起,思考未来世界该有的模样。
免疫治疗的春天来了吗?
春节过了,2019年的春天已经在路上了,这会同样是免疫治疗的春天吗?
这一问,想必读者们也颇有感触。2018年,国外PD-(L)1抑制剂终于登陆,国内企业紧随其后,市场仿佛一夜之间进入战国时代;而无论是药物疗效、既往困境的解决方案都有了比较大的进步;遑论,还有诺奖加身。
3月,耶鲁大学拿出了迄今为止最长时间的PD-1抑制剂临床随访数据,晚期非小细胞肺癌五年生存仅有1-8%的历史就此结束了。
不考虑药物剂量,所有患者的5年生存达到了16%,其中3mg/kg组更是令人惊艳的26%。研究结果还显示,PD-1抑制剂疗效相当持久,部分患者虽然早期停药,但响应却是持续的。
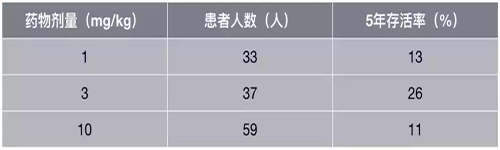
不同剂量的五年生存率数据
这已经足以说明,免疫治疗正在改变癌症治疗的现状。
研究中还提到,患者的生存时间和PD-L1的表达水平是正相关的。这也是免疫治疗之前一直没能解决的问题,到底用什么指标来预测患者的免疫治疗效果呢?
最开始,科学家和医生就是用PD-L1作为标准的,但是在实践中这个观点逐渐被否定了,有的研究里,就算PD-L1表达≥5%,免疫治疗依旧不比标准化疗更好。
随着研究的进行,一个新的答案浮出水面——肿瘤突变负荷(TMB)。目前来看,TMB可能就是最优解了。8月,科学家们首次证实,血浆TMB可以准确预测免疫治疗的有效性,而且基于液体活检技术,侵入性小、可重复性高,临床潜力非常大。
根据一系列临床结果,2019版NCCN指南中,已经将TMB列为非小细胞肺癌患者接受免疫治疗的推荐检测方法。
当然了,TMB只是暂时的最优解,并不是最终解,依旧存在部分患者高TMB不响应、低TMB疗效却很好的情况,这说明未来还需要开发其他的生物标志物,联合分析才是王道。

NCCN指南
那不响应的患者到底是为什么不响应?
以前科学家一直认为,只要肿瘤中存在浸润T细胞,那么我们只要激活他们就能够阻挡肿瘤前进的脚步。谁能想到,肿瘤中干活的杀伤T细胞仅是少数,还有大量与癌症无关的“旁观者”T细胞呢?
另一项研究数据简直触目惊心。从研究中获得的肠癌和乳腺癌数据来看,大约只有10%的肿瘤浸润T细胞能够识别肿瘤,其他的都是“旁观者”。
可见,T细胞状态可能也得纳入免疫治疗效果评估的一环。实际上我们文章也提到过,2018年10月《科学》的一篇文章指出,同时检测T细胞的活性水平和TMB应该是个不错的方向。

免疫检查点抑制剂只是免疫治疗的一小部分(也是最接近中国患者的一部分),除此之外,CAR-T也在ALL治疗上拿下了优秀的成绩,TCR-T、CAR-NK等新生力量开始崭露头角,溶瘤病毒、癌症疫苗突破不断,科学家甚至还想出了给CAR-T装PD-1抗体这样的黑科技。
希望这春天能来得更猛烈一点。
他被忽视了吗?
2018年10月1日,举世瞩目的诺贝尔生理学或医学奖揭晓。
结果公布,“免疫检查点抑制癌症疗法”摘得桂冠,所有守在电脑前面看直播的中国观众先是一阵欢呼,又在看到获奖人只有美国科学家James P. Allison和日本科学家本庶佑(Tasuku Honjo)时,惊掉了下巴。
几乎所有人都在问,陈列平呢?
发出这个疑问的包括国内几乎所有的专家、学者和媒体人。面对“诺奖又颁错”的质疑,诺奖委员会的回应是,“在肿瘤免疫领域,做出重要贡献的学者还有很多,但Allison和Honjo的贡献从他们中脱颖而出”。
好,那我们就来看一看,到底都有哪些做出重要贡献的学者,他们的贡献又都是什么。

右边这个空位,想把陈老师P上
James P. Allison主要是因CTLA-4获诺奖的,但实际上CTLA-4最早是在1987年由法国科学家Pierre Golstein团队克隆的,它的配体CD80则是百时美施贵宝的Peter Linsley团队在1991年发现的,这两个都跟Allison没啥关系。
而阻断CTLA-4和配体的结合,可以显著增强免疫反应,则是芝加哥大学的Jeffrey A. Bluestone团队发现的,也正是这一发现促使他们提出CTLA-4有免疫抑制功能。
直到这时,担任加州大学伯克利分校癌症研究实验室主任的Allison才迟迟登场。
Allison迅速意识到,这一发现在癌症治疗中具有巨大价值。1996年,他率领团队在动物实验中证明,CTLA-4抗体可以增强免疫并治疗动物肿瘤;2010年,CTLA-4抗体的首个III期临床研究结果表明,该疗法对晚期黑色素瘤有效。
不难看出,Allison的贡献就在于将CTLA-4与癌症治疗联系了起来。遗憾的是,CTLA-4的抗癌效果并不是非常好,免疫治疗真正“爆红”,还是因为PD-1/PD-L1。
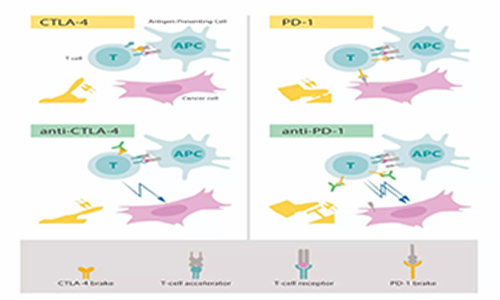
本庶佑在这里出场了。1992年,他所在的京都大学实验室发现了PD-1,但在之后几年里并没怎么重视它,直到1999年才报告,敲除小鼠的PD-1会导致小鼠出现自身免疫疾病,并由此得出了PD-1可能有免疫抑制功能的结论。
同样在1999年,在梅奥诊所任职的陈列平实验室首次报告了从人的正常细胞和肿瘤细胞中克隆到一个名为B7-H1的分子,该分子是第一个与肿瘤局部免疫反应抑制相关的分子,结合T细胞上的一个未知受体,能够产生免疫抑制功能。
2000年,本庶实验室与哈佛医学院的Gordon Freeman合作,证实了PD-L1能够与PD-1结合,从而抑制T细胞的增殖和细胞因子的分泌,负控淋巴细胞的激活。巧了,这个PD-L1,就是一年前陈列平实验室发现的B7-H1。
2001年,Gordon Freeman率先报道了另一个PD-1的配体PD-L2,其功能和PD-L1类似。
2002年,陈列平团队用单克隆抗体阻断PD-L1和PD-1的结合,初步证明可以解除局部免疫抑制。这个研究第一次证明肿瘤可能会利用PD-L1抑制肿瘤免疫反应。
2010年,全球首个PD-1抗体临床试验结果发布,O药从这里开始,陈列平在这个临床研究中也发挥了重要作用。

陈列平
稍微理一下过去的事儿,不难看出,PD-L1是陈列平团队首次克隆的,它在癌症免疫中的作用也是陈列平团队最早阐明的;除此之外,陈列平团队还首次证明PD-L1抗体有抗肿瘤的作用;就算只论PD-1抗体的功能,陈列平团队也是与本庶同时独立证明的。
相信大家都有结论了。
要奇点君说,专业领域的奖还是请相关专业的人来评比较好。同道中人,每个人的贡献多大,大家心里都跟明镜儿似的。
奖项这个东西,说实话对科学家重要也不重要,毕竟写在科学史上的不是那块奖牌,而是实实在在做出的科研成就,有这么多人鸣不平、为陈老师叫屈,说明大家都已经记在心里了。
液体活检能落地了吗?
其实这个问题,第一问里就能回答一部分。当免疫治疗走上主导,液体活检很可能会成为标配,再加上越来越多的靶向药,液体活检的辅助诊断地位基本已经确定了。
我们自然是希望液体活检能够越来越好,比如,先把辅助这两个字儿去了。

2018年,拿过两次普利策奖的王牌记者John Carreyrou出了本新书。这本Bad Blood(《滴血成金》)一经出版,在全球范围内引起了极大的轰动,一时间几乎所有人都在谈“滴血查病”。
人们真的太期待便捷的疾病检测方法了,特别是百病之王癌症,所以“滴血验癌”谣言每年都有,人们每年都想信。(奇点君自己也很想信)
遗憾的是,从技术层面上,“滴血验癌”我们还实现不了,不过看了2018年的相关研究,谁都会认同我们离它越来越近了。

“滴血验癌”的最大壁垒就是,要找到和癌症关联性足够强的生物标志物,这标志物还不能数量太稀少,不然是做不到“滴血”的。
2018年一开年,约翰霍普金斯大学的五位大牛就送上了一份大礼。这种名为CancerSeek的技术,能够同时对八种常见癌症进行早期检测,特异性能达到99%以上,而且这八种癌症有五种都还没有早检手段。
也没什么特别的(轻描淡写.jpg),大牛们利用计算机模拟选出了16个癌症相关突变和8个蛋白片段,对他们进行联合检测,在检测数量和质量中间取了个最高性价比,所以这项技术最终落地也不会太贵,研究者估计成本大概在500美元左右。
“滴血验癌”迟迟不能落地,另一个原因就是标志物太少了,比如说循环肿瘤细胞(CTCs)和循环肿瘤DNA(ctDNA),真的是,要多少,有多少,常规血检的量根本测不出来什么。
为了搞定这个问题,科学家们也是各出奇招。
比如说哈佛的放射学大牛Sanjiv Gambhir就想到,给癌细胞标记上磁性纳米粒子,然后用一根磁性金属线直接伸入血管,就能把CTC钓起来,效率比抽血高出10-80倍。有点想管这个教授叫“哈佛万磁王”哈哈。
剑桥的科学家们则是发现了血液中循环肿瘤DNA和非肿瘤DNA片段的长度分布特征,以长度作为区分富集,可以提高ctDNA的丰度,同时保证检测的灵敏性和准确性。实际使用这种方法来预测肿瘤进展,能够比CT成像早60天,比未富集的活检早89天,可以说是打开了液体活检的封印了。
2018年尾巴液体活检还刷了一波屏,闹得科学家赶紧出来解释技术离临床应用还远。不过十分钟检测几乎所有癌种,是真的很爆炸很黑科技了,不怪媒体们这么激动。
这套技术基于肿瘤组织或血液DNA的甲基化状况,只需要1pg DNA就能检测,并且配合了一种胶体金颜色指示剂,可以说是简单方便物美价廉了。不过它的缺点就是没法辨别癌种,可以作为筛查手段配合其他诊断。
期望这些“概念机”能够赶紧量产,让“滴血验癌”成真吧,再也不想辟这个谣了。
AI 会取代病理科医生吗?
2018年才讨论这个问题,显得我们好像有些跟不上时代,毕竟“人工智能颠覆医疗”最热闹的一年其实是2017年了。
当时斯坦福科学家用13万皮肤病变图片训练了谷歌的AI算法,和21位皮肤科医生进行了一场大比拼。卷积神经网络确实牛,在识别常见癌症和皮肤癌这两项任务上,都达到了专家水平。

上了《自然》的封面
国内外媒体报道之后,给人的感觉就是AI阅片已经不远了,除了担心失业的病理科医生们有点瑟瑟发抖,大多数人都很兴奋,国内涌现了一大批基于人工智能的医疗创业公司, 背后全都是令人眼红的资本。
澎湃了一年,大家明显淡定多了,很少有人谈论人工智能会取代医生,而是开始探索让AI成为医生们好助手的可能性。
2018年,AI第一次爆炸来自华人科学家张康。张教授团队开发的AI系统基于开源机器学习平台TensorFlow,植入Inception-v3算法,输入10万张准确标注的OCT(光学相干断层成像术)图像,诊断眼疾准确性达到96.6%,灵敏性97.8%。
比较厉害的是,这个系统经过迁移学习,可以轻松变身诊断肺炎的平台。在区分肺炎和健康状态时,准确性达到92.8%;即使是用来区分细菌性肺炎和病毒性肺炎,准确性也能达到90.7%。
在世界范围内,使用如此庞大的、标注好的高质量数据进行迁移学习并取得高度精确的诊断结果,得到与人类医生相似甚至更高的准确性,在世界上还是第一次。

《细胞》封面推荐
第二炸规模更大,点火者是来自全球100多个实验室的近150位科学家。他们开发了一个超级AI系统,基于肿瘤组织DNA的甲基化数据,可以准确区分近100种不同的中枢神经系统肿瘤。这个AI系统还能发现一些指南里面没有的新分类,对于癌症的精准治疗,又是个巨大的进步。
第三炸最惊奇。纽约大学学者利用大量数字化病理切片图像重新训练Inception V3,识别癌组织和正常组织准确率达到99%,区分腺癌和鳞癌的准确率达到97%,远超前人研究;不仅如此,该算法竟然能够从切片图像中识别肺癌常见六大基因突变,包括已有靶向疗法的EGFR突变,准确率能达到73%-86%。
这样看来,那块小小的病理切片中也还有着更多秘密可挖掘啊。

还有一点值得一提的是,AI也涉足免疫治疗领域了,而且可能可以解决一个困扰医生和科学家很久的大问题。
法国科学家开发了一个基于患者CT图像的AI系统,可以准确预测PD-1抑制剂治疗效果。该系统“钦定”有效的患者中位生存比预测无效的患者长了一倍以上(24.3个月 vs 11.5个月),效果相当明显。
不难看出,AI已经能完成相当一部分医学任务,帮助医生做决策了。难得的是,培养一个“火眼金睛”的顶级医生很难,拥有一个专家水准的AI“助手”却相对容易。
我们常看到各种顶尖的医学进展,但是从全世界范围来看,专业、高质量(甚至只是合格)的医疗资源在哪里都是稀缺的。就算在相对发达的城市,庞大的患者基数也会让专科医生供不应求, 大量病人不能及时转诊就医,从而延误就诊治疗的最佳时机。
AI能做的很多。诊前疾病预防、筛查;诊中辅助诊断、结果分析、辅助手术;诊后随访、慢性病监测、康复协助、健康管理;乃至在辅助科研、药物研发、基因筛选、医疗培训等方面,AI都会带来革命性的变革。
你能想到未来的模样吗?

肠道微生物过气了吗?
敲下这个小标题的时候,奇点君不由得笑了,过年之际谈起这个话题,还颇有一点辞旧迎新的感觉。
奇点几乎是看着肠道微生物成为一代“网红”的,每每发出相关研究,很容易收到读者的各种“肠道菌要统治世界”了的惊呼。不过再惊奇,惊奇多了也就司空见惯。2018年,看到稍微普通一些的肠道微生物选题,连奇点糕们自己也很容易觉得,“哎,肠道微生物,想想也挺正常”。
肠道微生物过气了吗?
还没。至少,目前攻克癌症最有希望的免疫疗法,还是得看肠道微生物的脸色。
2018年第一周,《科学》杂志连发三篇论文,证实肠道微生物在免疫检查点抑制剂治疗中起着决定性作用,再加上之前发表的两篇,可以说是坐实了患者对免疫疗法的响应、预后都得看肠道微生物。

《科学》封面
2015年,两个研究小组分别在小鼠中发现,CTLA-1和PD-L1抑制剂疗效竟然受到特定菌群的影响。这个震动肠道微生物和肿瘤两界的发现,又经过了两年的发酵,终于落下了人类患者中的实锤。
接受同样的PD-1抑制剂治疗,服用抗生素的癌症患者总体生存期(OS)竟然缩短了近45%!另两组研究者也分别鉴定出了具体的菌属。
这项发现对两个领域都不可谓不重大。肠道微生物宇宙边界再一次扩大,肿瘤免疫治疗也可能因此而再上一阶——如果有能增强免疫疗法的“便便胶囊”,吃吃又何妨呢?

其实不光影响免疫治疗效果,在肿瘤的生长过程中,肠道菌也没缺位,胰腺癌和结直肠癌这两种癌症都各自找到了一大群相关菌属。
既然它们愿意掺和,那咱们大可以利用一下。值得骄傲的是,首个基于肠道微生物的肝癌早诊AI模型,还是诞生在中国的。对于肝癌大国来说,如果真的能够降低肝癌早诊难度,可以说是功德无量了。
另一项同样来自中国科学家的研究给2型糖尿病带来了新解决方案。国内的肠道微生物大牛赵立平教授团队确定了膳食纤维饮食可以调节特定的肠道菌群,3个月的饮食干预可以使试验中89%患者的糖化血红蛋白达标。这项研究还鉴定到了特定的菌株,可以说是很厉害了。
其他的“肠道微生物教你吃”系列还包括红肉害心血管、膳食纤维补骨等等,但天然食品表现出了各自的好,膳食补充剂却有点跌跟头。
2018年,《细胞》杂志发了三篇论文,分别提出了补充益生菌和可溶性膳食纤维可能带来的健康隐患。这二者均是我们常识中有助于健康的补剂,特殊情况下还可以用于缓解某些疾病的痛苦。但从这三项研究结果来看,肠道菌组成的个体化差异很大,流水线产品或许并不是相关问题的最佳解决方案。
再多想一步,粪菌移植这项技术到底该走向何方还需要更多的考虑。
南方医科大学进行的研究指出[1],跨全国14个省市的七千余人中,与肠道菌群最强的关联因素是被试所处的地理位置,特定地区基于肠道菌的诊断模型,很可能不能推广到其他地区。
国外学者的研究也显示[2],肠道菌在很大程度上受到饮食、药物等各种因素影响。那么在进行粪菌移植的时候,为了保证目标菌的稳定定殖,这些因素是否需要考虑进去呢?
除此之外,在国内,粪菌移植到底在什么情况下使用、到底归类为哪一种治疗、相关的临床和菌群资料如何管理等等更多相关伦理和政策的问题也需要解决。

不管怎么说,纵观过去一年,不难看出研究方向正在走向更加精准,重磅结果往往都标配特定的菌种乃至菌株。正如赵立平教授所说,不同菌株间基因序列差异远大于人与小鼠的区别,研究精确到菌株是精准治疗的前提。
其实以肠道的神秘地位、微生物漫游人体的自由度,肠道微生物涉事之广,必然远不止目前我们所了解的这些,这个领域绝对还有大把令人震惊的未知等待发掘,而走上临床的肠道菌也仅仅是刚起步。
总而言之,你的人生,肠道微生物永远不会缺席。
二甲双胍到底还有多少我们不知道的功能?
辞别旧日网红,该迎新神上位了。
说起神药,大家第一个想到的必然是阿司匹林。俗话说长江后浪推前浪,前浪拍成沙茶酱,阿司匹林去年迎来一波神格下跌,新神可在路上一往无前呢。
满打满算,2019年,二甲双胍就正式在临床服役62年了,它依旧是目前全世界处方量最大的口服降糖药,地位无可撼动。直接把它一路送上神位的是,二甲双胍不光能降血糖,什么护心、防癌、抗衰老,似乎都能手到擒来!

二甲双胍的心血管益处已经写进指南,就不多说了。二甲双胍可能能抗癌这一点,很早之前就有流行病学证据显示,使用二甲双胍治疗的2型糖尿病患者癌症风险更低。
复旦大学学者发表在《自然》杂志上的研究为我们揭示了其中的奥妙。原来,高血糖水平诱导特定表观遗传变化的通路,竟然和二甲双胍降糖通路有重叠,下游更是涉及到了多个与癌症相关的基因。
另两项研究则把这个结论推广到了糖尿病患者之外的人群。科学家们发现,在肿瘤微环境中,天冬氨酸是肿瘤增殖的关键限速因素,缺少天冬氨酸,肿瘤就束手束脚。而2016年的一篇论文告诉我们,二甲双胍可以降低细胞中天冬氨酸的水平。

还有更神的,二甲双胍还能降解癌细胞的PD-L1!万万没想到,免疫治疗这个热点集中营,二甲双胍也能掺上一脚,“管闲事”能力堪比肠道微生物,哦,二甲双胍和肠道微生物也有好几腿……
最令人献上膝盖的是,二甲双胍竟然还有“防霾”功效,抑制雾霾引起的动脉血栓,预防心血管疾病发生。
二甲双胍为啥这么神?有科学家做了个研究,用新技术研究了一下二甲双胍能够影响到的分子通路,发现二甲双胍至少能够影响745种蛋白的活性。其实奇点君觉得,这个hdPCA技术胜在准确,在全面上还差了一些,这也说明二甲双胍能够调控的通路大概远不止这几百个。

纵观这些“神药”,大抵都经典、便宜、“万能”。
阿司匹林和二甲双胍的年纪都远超在座的各位,它们诞生的那个年代,药物研发还没有今天这么精准,所以很多经典老药都是知其然不知其所以然,用着用着就发现一条新作用通路,也没啥奇怪的,至少阿司匹林和二甲双胍这俩我们现在还没全搞清楚呢。
按照今天的这种先找靶点再对应开发的套路,恐怕以后很难再出现新的“神药”了,且用且珍惜(笑)。
不过“神药”本来也难得,这么多年不就出了这么两个。下一个是谁呢?奇点君决定捧一把他汀,看看它19年是否争气吧。如果真火了,记得回来打钱。
心血管还好吗?
同为慢性病,糖尿病和心血管疾病受到的关注度完全不一样。这是奇点编辑部的一大未解之谜,就感觉我们读者,好像也不咋在乎自己的小心脏。
为什么这样呢,明明按照某指南,在座一半人都高血压了啊?

说起美国心脏协会(AHA)和美国心脏病学会(ACC)17年尾发布的这个新版高血压临床指南,奇点君自己也觉得胆战心惊,高血压门槛降到了130/80mmHg,让很多人都大呼“怎么我一觉醒来就高血压了?”北京阜外医院做了个调查,根据这版指南的标准,中国成年高血压患者已经超过5亿了!
不过中国人是心真大。。。虽然患者人数坐火箭似的窜,但患者知晓自己患病和接受治疗的比例都不到一半,患者血压控制达标率仅有15.3%。哦,要是按照AHA/ACC的标准,就只有3%……
朋友们,不要以为自己年轻就可以作天作地了,病到头上饶过谁啊!

那就提前开始预防呗?可惜,预防心血管疾病的阿司匹林和深海鱼油这两大扛把子,都坑了。
2018年中,《柳叶刀》和《新英格兰医学》杂志两大顶级期刊分别发文,指出阿司匹林用于心血管疾病一级预防的一些问题,一是指南推荐的剂量并不适用于所有体重的患者,二是这个用法对中低危和糖尿病患者基本也没有健康收益。
一时间议论纷纷,曾经的神药,说不好就此跌下神坛,也有些令人感慨廉颇老矣。
而ω-3脂肪酸补剂,AHA给出的冠心病二级预防建议,也分别在队列研究和对照试验中折戟。顺便一说,ω-3脂肪酸的药物版本的确可以用来治疗高胆固醇,但是药物和补充剂的使用还是有区别的。
新的一年里,保护小心脏可以从改变生活方式做起,比如说多吃西兰花,每天一个鸡蛋,以及好好保护牙齿。对了,北大团队的结果也说,那些血小板低的高血压患者大可以尝试下补叶酸,防中风效果还是挺好的。
阿尔茨海默病快放晴了吗?
之前年刊写到阿尔茨海默病的时候,两个子标题都没有离开“迷雾”这个关键词。不知道病怎么来,不知道病怎么发展,更不知道怎么治,这个一问三不知还有着目前新药圈最大的“3期临床百分百失败”设定,真的是够让人难受了。
说实话,AD的新药研发可能会越来越不乐观。2018年1月,辉瑞宣布放弃所有神经退行性疾病研发管线,公司前研究和开发负责人John LaMattina指出,AD的研究非常昂贵,因为疾病进展缓慢,等待药物起效可能需要数年时间,每个3期临床试验的费用可能在6-10亿美元之间。
LaMattina表示,就算是辉瑞这样的头部企业,也很难支撑起这么大规模的预算,其他大型制药企业早晚也要跟着放弃,最终为了补这个研发的缺口,很可能是美国国立卫生研究院(NIH)来撒钱[3]。
一语成谶。这话刚说了半年,美国国会即宣布,将NIH阿尔茨海默病和相关痴呆的年度预算直接乘3,总额达到19亿美元;另外,NIH还发布了两份2019年支出法案草案,在这方面的投入金额将达到23亿美元,占NIH全年预算的5%[4]。
这是NIH历史上第三次把大量经费都集中在同一领域——第一次是1971年开始的癌症战争,上一次则是为了对抗艾滋病。

很多研究者表示心情复杂,他们担心经费集中会耽误其他领域的发展,但却没什么人直言反对。AD确实快到刻不容缓的时候了,除了卫材和百进又把BAN2401的2期数据拿出来挣扎了一下之外,AD新药的失败名录又多了一串名字,哎,不提也罢。
其实β淀粉样蛋白理论走到今天,临床试验屡屡败走,已经容不得人不质疑了,反倒是一些“老”理论,在这风口浪尖上重获生机,比如说疱疹病毒,终于暗搓搓地拿回了它AD幕后黑手的宝座。
AD的病毒理论,其实能够追溯到上个世纪五十年代,只是搞这个研究的学者是少数派中的少数派,无人问津不算惨,因为学术追求还要被嘲笑那是真的惨。几十年的积累,病毒理论迎来一波大爆发,疱疹病毒之后,又有逆转录病毒掺一脚。关注奇点的读者应该最近也有看到,2019年1月,又接连有几篇相关论文发表,这里就不列举了。

的来说,虽然药物研发不甚乐观,但我们对AD的认知进步是很大的,包括BACE1与神经功能的关联、APOE突变致病的机制、tau蛋白的真实功能、β淀粉样蛋白可能可以传染,AD正在逐步揭开神秘面纱。
另外还有一个绕不开的事件。中国海洋大学、中科院上海药物研究所和绿谷药业联合研发的AD药物甘露寡糖二酸(GV-971)宣布顺利完成临床3期试验,能明显改善患者的认知功能障碍。
研究论文目前还没有发表,没看到论文之前,奇点君也不好说些啥。
既然是十问,那也不妨来个问中问,北大饶毅老师的实名质疑,质疑到结果了吗?
CRISPR进入瓶颈了吗?
2018年,天之骄子CRISPR好像走进瓶颈期了。
开年第一周,斯坦福大学学者论文质疑,CRISPR/Cas9系统真的能在人体内起效吗?根据科学家们的实验结果,七成健康人体内都存在Cas9蛋白同源物抗体,半数人具有特异性T细胞,这意味着目前最成熟的Cas9编辑在人体内的有效性和安全性都打上了问号。(注:这篇论文最终发了《自然医学》)
道理也很简单,Cas9蛋白来源于微生物,尤其是金黄色葡萄球菌和化脓链球菌,这差不多是最常见的两种致病菌了,几乎100%的成人都具有相应的抗体。这意味着,人类的适应性免疫将会成为CRISPR/Cas9基因疗法的巨大壁垒。

另外两篇论文则将CRISPR与最常见的抑癌基因突变p53扯上了关系。来自卡罗林斯卡和剑桥的两个团队分别证实,CRISPR/Cas9基因编辑过程中造成的DNA双链断裂,实际上可以激活p53蛋白通路,编辑成功细胞往往具有p53缺陷——也就是潜在的癌细胞!从研究结果来看,涉及DNA双链断裂的基因编辑风险极大,很可能会增加临床患癌风险。
这还没完,遗传学大牛Allan Bradley团队则证实,CRISPR/Cas9介导的双链断裂修复极有可能造成切割位点远端DNA大片段丢失、乃至其他更为复杂的基因突变。从某种角度来说,这比脱靶还要严重,毕竟第一,丢失片段可能高达数千bp;第二,发生位置远难以通过常规流程评估;第三,随机性强,每个样本编辑后基因型都有所不同,潜在致病模式多得无法想象。
纵然Editas等前沿CRISPR企业面上淡定,但股价的过山车式波动实实在在地反映出了资本市场对技术的担忧。

其实奇点君倒觉得,问题频出,未必不是好事。
CRISPR是由一位日本科学家命名的。1987年,他把这段搞不清楚作用的序列写进了论文,可绝对没有想到它们能以坐火箭的速度改变医学世界。
2012年前后,Jennifer Doudna、Emmanuelle Charpentier、张锋和George Church四尊创世天神同时发力,证实了CRISPR作为一种基因编辑工具的无限潜力;之后不到一年,便有研究者开始尝试利用CRISPR来矫正遗传疾病;2016年,卢铀进行了首个CRISPR编辑细胞回输的临床试验;2017年,CRISPR实现单碱基编辑……
快吗?太快了,估计上一问搞AD药物研发的同行都要流下泪来。

有句话不太好听,步子迈太大,早晚要扯淡,还不如现在这样一点点发现问题、一点点解决问题。现在科学家们也在开发CRISPR更加广泛的潜力,比如说更多更优秀的Cas酶、更好的递送方式、不切割双链的编辑方法等等。
何况CRISPR作为一个编辑工具,确实是挺好用,快速、精准、体量小、自由度高,“基因魔剪”绝非浪得虚名。比如快速制造TCR-T、改造癌细胞大义灭亲,CRISPR能做的还多着呢。
没有技术是完美的,CRISPR更不是。科学需得一步一个脚印,每一步前进都是摸着石头过河。2018年8月底,科学家终于首次实现了CRISPR/Cas9系统在大型动物体内的编辑,让关注这个技术的人们狠狠兴奋了一把。
当然,在另外一个“爆炸式进展”面前,如今看起来它也“不算什么”。
他怎么样了?她们怎么样了?
年度最不想吃的瓜,贺建奎。
2018年11月25日,麻省理工的评论期刊MIT Technology Review发表了一篇报道[5],根据中国临床试验注册中心发布的文件,把贺建奎事件拉上了水面。次日,该事件大规模发酵,贺建奎在YouTube上传视频,宣布一对名为露露和娜娜的双胞胎女婴于2018年11月8日出生,这是世界上第一例人类基因编辑婴儿。
此处本来有一个贺建奎声明视频,但是传了,没过审
该试验招募的受试者为HIV携带者男性/健康女性夫妻,以CRISPR/Cas9技术对受精卵进行基因编辑,以得到具有CCR5基因突变人类胚胎。天然CCR5-Δ32突变携带者可在高风险暴露的条件下抵抗HIV感染。
贺当时正在香港,准备参加11月27日举办的第二届国际人类基因组编辑峰会。会议临时为贺准备了发言时间。不知是因为贺英文水平所限,还是的确心里没有底气,整个问答环节只能说是避重就轻。
在各界关注之下,事件有关细节逐一曝光,试验目的、伦理审查、项目资金来源、临床备案、安全性、知情同意等皆被质疑。
峰会结束之后,贺建奎一度杳无音讯,传言称贺建奎被隔离在南方科技大学公寓中,公寓外有便衣执勤。这期间,贺与斯坦福大学William Hurlbut博士有邮件来往,称自己“在双方协议之下”居住在大学的公寓中,可以自由离开[6,7]。

12月29日贺建奎在公寓阳台
2019年1月21日,新华社公布该事件初步调查结果,最终定性为“贺建奎个人为追逐名利、自筹资金、蓄意逃避监管、私自组织有关人员,实施国家明令禁止的以生殖为目的的人类胚胎基因编辑活动”。

对于这件事,国内外学界几乎是一边倒的批评,仅有George Church发言较为中立,认为在HIV大流行的前提下,以预防艾滋病为目的的基因编辑并非无用功,但对开展胚胎编辑一事也持否定态度。 就试验本身来说,受试者夫妻并不需要进行基因编辑就可以生下健康的宝宝,而且从结果来看,露露和娜娜的编辑也说不上成功;试验之外,编辑人类胚胎是绝对违反国际伦理标准的行为,更遑论让“实验品”出生。
中国期待着世界领先水平,但绝不需要这样的第一。
这件事疑点重重。贺建奎虽然并非遗传学家,但总归有生物物理学科背景,也算是相对有一定履历的研究者,他会真的完全不了解个中风险吗?所谓的“个人行为”是真是假?贺建奎这样做的目的到底是什么?
期待进一步调查能够解决以上的疑问。
《自然》杂志评选2018年度十大人物,贺建奎赫然在列。作为“反派”,贺建奎打开了基因编辑的“潘多拉魔盒”,给全世界投下一颗重磅炸弹。
奇点君的一个小观点,不一定对。事物必然有恶性和良性两面,贺建奎事件之后,相关立法和监管必然大幅前进,国际上对基因编辑伦理将有更加严谨、统一的认识,普通人也会对看似高深的科学领域有更深的了解。只要还在讨论,就会进步。
有些人等待被审判、有些规则等待被建立、有些历史等待被改写。
唯一让我们觉得无能为力的是,两个女孩、或许还有更多尚在孕育的胎儿,只能被动地接受被他人编辑好的命运。

如涉及知识产权,请与我司联系!
|