来源:生物制药小编 发布时间:2019-7-12
1
Libtayo®(cemiplimab)在欧洲条件性获批上市,用于皮肤癌的治疗
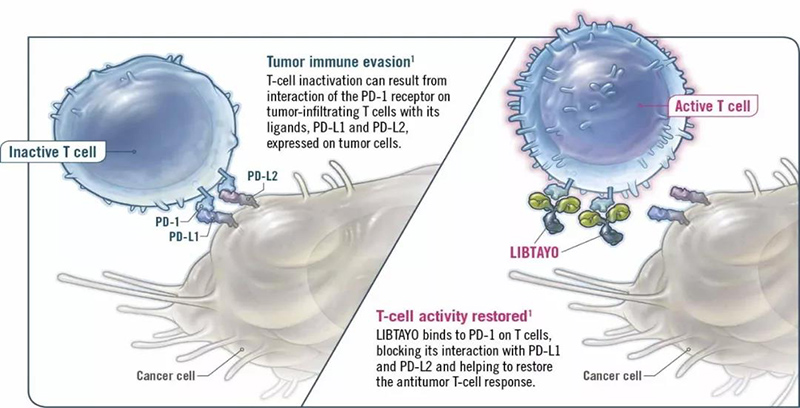
7月1日,法国,Regeneron和赛诺菲今天联合宣布,欧洲委员会已批准Libtayo®(cemiplimab)有条件上市,可用于不适合手术或放疗的转移性或局部晚期皮肤鳞状细胞癌(CSCC)成人患者的治疗。Libtayo是一种靶向PD-1的全人源化单克隆抗体,是欧盟唯一获批治疗晚期CSCC的药物。CSCC在一些欧洲国家的发病率明显高于其它地区,尽管绝大多数CSCC患者早期发现并接受治疗后能获得良好预后,但当癌症进展到晚期时治疗就会变得极为困难,目前的数据显示晚期CSCC患者的预期寿命约为一年。Libtayo的推荐剂量为每3周350mg,通过30分钟静脉内输注给药,直至疾病出现进展或者出现耐受性问题才会停止治疗。Regeneron和Sanofi仍将进一步推动该领域的研究,系统性评估Libtayo的利益风险状况。
2
Tecentriq+紫杉醇用药组合治疗三阴性乳腺癌的治疗策略获得CHMP的积极推荐
7月1日,意大利,罗氏今天宣布CHMP建议批准Tecentriq®(atezolizumab)加紫杉醇用于治疗PD-L1阳性的无法切除的局部晚期或转移性三阴性乳腺癌患者。CHMP的建议基于III期临床IMpassion130研究的数据。该研究表明,与单独使用紫杉醇相比,Tecentriq加紫杉醇对于疾病恶化或死亡风险降低了38%(PFS:7.5个月 vs. 5个月),此外患者的总生存周期延长了7个月(25月 vs. 18月)。Tecentriq加紫杉醇的组合用药的严重不良事件(SAE)为23%,此外组合用药并未增加新的安全性事件。CHMP的积极推荐标志着三阴性乳腺癌治疗的突破,在欧洲的三阴性乳腺癌PD-L1阳性患者有望快速获得Tecentriq组合用药的治疗。
3
康方生物的双特异性抗体AK112在美获得临床试验许可
7月1日,中国,康方生物宣布其自主研发的PD-1/VEGF双特异抗体新药AK112获得FDA批准开展临床研究。AK112是该公司在研的肿瘤免疫治疗药物,由其双特异性抗体平台Tetrabody开发获得。继AK104获得临床试验许可后,AK112是该公司在美获批临床的第二款双特异性抗体药物。
4
Bioinvent公司的抗FcγRIIb抗体临床试验申请获得FDA批准
7月2日,瑞典,BioInvent公司今天宣布该公司的抗FcγRllB抗体已经获得FDA的批准开展I/IIa期临床试验。抗FcγRllB抗体是BioInvent的F.I.R.S.T™技术平台开发获得,这种抗体可能会提高抗PD-1靶向抗体的治疗效果,此次将开展的临床主要是探究其改善实体瘤临床应答的可能性。 
5
再鼎生物和Incyte公司达成协议,获得INCMGA0012在中国的开发和商业化许可
7月2日,中国,再鼎生物和Incyte公司今天联合宣布已经就INCMGA0012(一种研究性抗PD-1单克隆抗体)在大中华区的开发和商业化达成合作和许可协议。INCMGA0012是一种抑制PD-1的研究性单克隆抗体,目前该药在少部分子宫内膜癌、Merkel细胞癌和肛门癌患者中进行疗效评估。根据协议条款,再鼎生物将预先向Incyte支付1750万美元,并获得在中国大陆,香港,澳门和台湾地区开发和专门商业化INCMGA0012的权利,此外Incyte有望获得额外的6000万美元里程碑付款和部分版税。
6
复宏汉霖的HLX10联合化疗治疗局部晚期/转移性食管鳞癌的III期临床研究正式开始
7月2日,中国,复宏汉霖今日宣布其在研药物HLX10联合化疗治疗局部晚期/转移性食管鳞癌(ESCC)的III期临床已经完成首例患者的入组治疗。HLX10是复宏汉霖自主研发的创新型抗PD-1人源化单克隆抗体,该药可广泛用于多种实体瘤的治疗。此次开展的随机、双盲、多中心III期临床试验旨在评估HLX10联合化疗一线治疗局部晚期/转移性食管鳞癌患者的临床疗效,次要终点是药物的安全性和耐受性。
7
GSK将启动otilimab治疗RA的III期临床研究
7月3日,英国,GSK今天宣布启动一项III期临床开发计划,旨在评估otilimab(抗粒细胞巨噬细胞集落刺激因子单克隆抗体)对于中度至重度类风湿性关节炎(RA)患者的疗效。此前的II期BAROQUE研究已经证实,otilimab治疗能够给患者带来明显的临床获益。此次即将开展的3期临床将比较两种剂量的otilimab(每周皮下注射90mg和150mg)对于改善患者对tofacitinib或sarilumab治疗的应答水平以及药物的安全性,研究的主要终点是在治疗第12周时患者达到ACR20(美国风湿病学会标准)的比例,次要终点包括临床疾病活动指数(CDAI)评分等。
Otilimab是一种完全人源化单克隆抗体,其靶点是GM-CSF——一种在免疫疾病中发挥重要作用的蛋白质。GM-CSF作用于细胞会诱导炎症,造成关节损伤和疼痛,otilimab通过阻断GM-CSF与其细胞表面受体的相互作用来中和GM-CSF的生物学功能。
8
C5补体抑制剂ULTOMIRIS®(ravulizumab)在欧洲获批PNH的治疗
7月4日,美国,Alexion制药今天宣布,欧盟委员会已批准长效C5补体抑制剂ULTOMIRIS®(ravulizumab)用于治疗阵发性睡眠性血红蛋白尿(PNH)的成年患者。PNH是一种由于造血干细胞PIG-A基因突变造成的罕见疾病,PIG-A突变造成糖基磷脂酰肌醇合成异常,导致由GPI锚接在细胞膜上的一组膜蛋白丢失,临床上主要表现为慢性血管内溶血,造血功能衰竭和反复血栓形成等。欧盟委员会的批准是基于两项3期研究的综合结果,这些研究表明ULTOMIRIS拥有与现有药物SOLIRIS相似的临床疗效和安全性,此外ULTOMIRIS能够持续抑制C5活性长达8周,并且能够消除与不完全C5抑制相关的溶血事件。

9
免疫球蛋白皮下注射剂Xembify®获得FDA批准上市
7月4日,西班牙,Grifols公司今日宣布FDA已经批准该公司的免疫球蛋白皮下注射剂Xembify®上市,用于治疗原发性免疫缺陷。免疫球蛋白主要用于治疗原发性和继发性免疫缺陷,以及罕见的神经系统疾病,如慢性炎症性脱髓鞘性多发性神经病(CIDP)。XEMBIFY是一种浓度为20%的免疫球蛋白溶液,用于治疗2岁及以上患者的原发性体液免疫缺陷(PI)。
10
GamaMabs公司公布了murlentamab治疗转移性结直肠癌研究的最新进展
7月5日,法国,GamaMabs公司今天宣布在世界胃肠癌学术会议(ESMO)上公布其正在进行的murlentamab治疗转移性结直肠癌(mCRC)的II期临床最新进展。Murlentamab是一种选择性靶向AMHRII的单克隆抗体,AMHRII是一种胚胎受体,在多种实体瘤中高表达,murlentamab主要通过肿瘤相关巨噬细胞重编程发挥其抗肿瘤活性。GamaMabs公司的研究数据显示,murlentamab与三氟尿嘧啶联合使用能够延长患者的无进展生存期,此外用murlentamab单药治疗和murlentamab联合三氟尿嘧啶治疗,分别观察到肿瘤生长速率下降1.7倍和3.6倍。安全性方面未见到与murlentamab有关的严重不良事件。

如涉及知识产权,请与我司联系!
|