来源:生物制品圈
摘要
基于PD1/PD-L1的治疗给肿瘤治疗带来了革命性的改变,截止2018年底,超过100多种anti-PD1 和 anti-PDL1 处在研发的不同阶段,超过2000多个临床研究试验注册。抗体的特性需要通过生物学检测方法判定其生物学活性。在本文中,我们开发了一种基于细胞的生物学检测方式用来评估anti-PD1 和 anti-PDL1 抗体的生物学活性。我们选择了包含两个细胞系的受体报告系统,比较了超抗原,可溶性Anti-CD3抗体,膜型Anti-CD3抗体,嵌合抗原受体(CARs),双特异性T细胞招募抗体对效应细胞的激活。我们对该生物测定方法进行了表征,并证明其可用于分析anti-PD1和anti-PDL1的活性。所提出的生物测定方法可用于开发新的治疗药物及其表征方法。
程序性死亡受体1(PD1)主要表达于激活的T细胞表面。PD-1+淋巴细胞 与携带PD-1天然配体(PD-L1 或 PD-L2) 的抑制性淋巴细胞结合后,将抑制PD-1+淋巴细胞的活性。PD1与其配体形成复合物导致了T细胞CD3依赖性激活被阻断。尽管与PD1相互作用的精确序列仍然不清楚,但是与PD1相互作用的蛋白质,以及受这种相互作用影响的信号级联已被确定。免疫反应的抑制,保护机体不受T淋巴细胞过度活化和自体免疫反应的影响,但同时也抑制了机体对肿瘤细胞的免疫反应。
抑制PD1与PDL1的相互作用,而不是与PDL2相互作用,可以消除负性免疫调节,是治疗某些类型肿瘤最成功的策略之一。2018年,T.Honjo由于在免疫负性调节研究中的突出贡献,获得了诺贝尔生理医学奖。第一款PD-1和PD-L1抗体药物分别在2014年和2016年上市。截止2018年年底,有关PD1/PD-L1抑制剂的临床试验高达2000多项。
治疗制剂的表征需要开发用于检测其生物活性的合理方法。理想情况下,生物学分析方法应当反映生物制剂的作用机制,实现定量比较生物制剂的不同。目前所使用的方法要么受到专利的限制,要么是基于人体原代细胞,这使得它们使用不方便,结果再现性差。我们的目的实构建一种用于检测anti-PD1 和antiPDL1抗体的生物学检测方法,免于专利和原代细胞使用的种种限制。
材料与方法
材料
DMEM/F12和RPMI1640培养基(PanEco, Russia) ,灭活的胎牛血清(Gibco,
USA) ,经典单克隆抗体抗人PD1 (aPD1) ,抗人PDL1 (aPDL1) 抗人CTLA4抗体,(aCTLA4) ,抗人HER2(aHER2) ,抗人CD3和肿瘤相关抗原1的双特异性抗体(aCD3/aTAA1) ,以及抗人CD3和肿瘤相关抗原2的双特异性抗体(aCD3/aTAA2) (BIOCAD,Russia) 鼠抗人CD3单克隆抗体,克隆号HIT3a(BD, USA) ;ONEGlo luciferase Assay System (Promega, USA) 和葡萄球菌肠毒素B(SEB)(Toxin Technology, USA) .
细胞系
Jurkat和Raji培养于含10%FBS的RPMI1640;CHO-K1培养于含有10%FBS的DMEM/F12 。培养条件,37℃,5%CO2。所有细胞系用于基因工程化细胞株构建,所有细胞系均经过试剂盒以及PCR法检测支原体污染。VenorTM GeM Mycoplasma Detection Kit, PCRbased (Sigma Aldrich, USA).
载体构建
基于pOGI载体(BIOCAD) 构建pOGI-NFATFLuc 质粒;该载体包含萤火虫荧光素酶,受IL2启动子控制,该启动子中含有3个重复的NF-AT(激活的T细胞核因子)结合序列,该载体中还含有潮霉素抗性基因。
基于pSX 载体(BIOCAD),构建了pSX-tmaCD3, pSX-PD1,和 pSX-PDL1 质粒。pSX-tmaCD3质粒包含抗人CD3抗体OKT3 单链可变区片段scFv,融合了血小板生长因子受体跨膜区,融合基因受CMV启动子驱动,该载体也包含了嘌呤霉素抗性基因。pSX-PD1在多克隆位点插入了人PD-1基因,受CMV启动子控制。该载体包含新霉素抗性基因。pSX-PDL1 包含了人PD-L1基因,受CMV启动子控制,该载体还包含新霉素抗性基因。
稳转细胞系构建
Jurkat NFAT FLuc 细胞系通过将pOGI-NFATFLuc 载体电转化Jurkat细胞制备,在含有潮霉素B的培养基中培养筛选稳定细胞株。并通过加入aCD3 ,筛选在aCD3 存在时,报告基因最高表达的稳转细胞株。
Jurkat NFAT FLuc PD1 细胞系通过将pSX-PD1 质粒电转化进Jurkat NFAT FLuc 细胞制备,在含有新霉素的培养基中进行筛选,并通过流式细胞筛选表面高表达PD-1的细胞株。
Raji PD-L1 细胞系通过将pSX-PDL1 质粒电转化进Raji细胞,在含有新霉素的培养基中筛选,并通过流式细胞筛选高表达PD-L1的细胞系。
Jurkat NFAT-FLuc PD1 CAR 细胞系来源于慢病毒转导Jurkat NFATFLuc PD1细胞系,该慢病毒编码一个嵌合抗原受体(CAR),该CAR通过T2A多肽链接子连接GFP荧光蛋白融合表达(BIO-CAD)。转导细胞系通过流式细胞术筛选GFP阳性细胞,最终得到Jurkat NFAT-FLuc PD1 CAR细胞系。
CHO PDL1 tmaCD3细胞系通过质粒pSX-PDL1 和pSX-tmaCD3转染CHO-K1细胞,在含有新霉素/嘌呤霉素的培养基中得到筛选,最后通过流式筛选细胞表面高表达PD-L1和表达跨膜型CD3抗体aCD3 (tmaCD3)的细胞系,PD-L1通过PD-L1抗体检测,aCD3通过FC检测。
生物学功能检测
在白色96孔板上进行发光分析(SPL Life Sciences, Korea Republic). 除非另有说明,细胞悬液中含有50,000 Jurkat NFAT FLuc每孔培养25,000个Raji PDL1细胞和1 ng/ml浓度的aCD3/aTAA1。在一些实验中,Jurkat NFAT FLuc PD1细胞被替换为Jurkat NFATFLuc PD1 CAR细胞(每孔50000个细胞)或Raji PDL1细胞被Raji或CHO PDL1 tmaCD3细胞(25,000个/孔)。最终,每孔细胞悬液的体积为100ul。所有的反应都在含有10%FBS的RPMI1640培养基中进行,加上所有的反应原件,培养板在37℃,5%CO2 培养箱中培养16h,然后通过ONEGlo分析系统和SPARK 20M酶标仪(Tecan, Switzerland)读取发光强度。
数据处理
根据方程,利用四参数logistic近似配位函数绘制细胞活化对抗体浓度的依赖关系曲线::
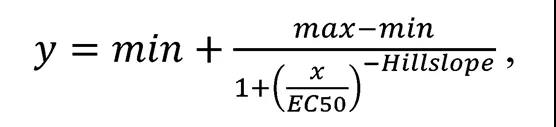
其中x为抗体浓度,ng/ml;max是上渐近线; min是下渐进曲线,坡面是曲线的曲率,EC50为半有效浓度,ng/ml。
这些图是用SigmaPlot程序包(SYSTAT软件)近似拟合得到的。所有的实验测量至少进行了两次。图中所示值为所有重复的平均值;误差条是标准差。
aPD1和aPDL1的稳定性
取浓度为25 mg/ml 的aPD1和aPDL1 50 μl,分别置于PCR管中,置于PCR反应器中(BioRad, USA)在指定的温度下加热处理1h,随后的分析根据生物学功能分析操作指南进行。
生物分析线性范围
为了比较实验值与期望值之间的差异,分别根据标准品反应最大值, 100μg/ml浓度为100%活性为参照,稀释aPD1 和 aPDL1抗体浓度分别为最大活性的200, 140, 70, 和50%。再根据生物学功能分析操作指南进行。活度计算为标准样品的实验测定的EC50与给定浓度的实验测定的EC50之比×100%。
结果与分析
细胞系的产生
在生物学分析中,最好使用永生化的细胞系来避免元代细胞准确性和重现性的问题。也可以通过基因工程手段得到想要的细胞表型。一个用于分析aPD1或 aPDL1抗体生物学活性的系统中,应该包括PD-1+的效应细胞和表达PD-L1的细胞。pd1介导的对CD3依赖激活的抑制意味着效应细胞必须在其表面携带有功能的CD3复合物。为了评估CD3依赖的激活,报告系统可以使用,例如荧光素酶报告系统。PD-L1和PD-1相互作用的结果是抑制了依赖于CD3激活的T细胞的NFAT和NF-κB(核因子,激活B细胞的κ轻链增强子)信号。最好使用NFAT介导的通路,因为NF-κB信号可以被很多其它物质刺激,例如CD3依赖激活的特异性标志物较少。
来自人T细胞的Jurkat细胞系符合用于CD3依赖的激活T细胞研究的要求,已经使用多达30年。在我们中,我们准备了NFAT FLuc PD1稳定细胞系,可以表达PD-1并且在NFAT反应的启动子下,控制着报告基因的表达。
获得了两个PDL1+细胞系Raji和CHO PDL1 tmaCD3
选择一种细胞激活效应的方法
除了效应细胞外,测试系统还必须包括PDL1和CD3激活因子。利用PDL1+细胞作为PDL1的载体是目前最常用的物理方法。
我们的测试系统已经考虑了CD3激活的几个变体(图1):
a)T cell受体(TCR)与特定肽形成复合物和主要组织相容性复合物(MHC)的相互作用最类似于其自身的作用机制(图1a);
b)超级抗原可以结合在2型MHC(MHCⅡ)中TCRβ链,这一结构模拟了TCR与MHC/Peptide形成复合物(图1b)。我们中用SEB作为超级抗原;
c)可溶性的激活性anti-CD3ε抗体最为常用,以激活CD3(图1.c);
d)跨膜型的anti-CD3ε抗体也经常用于aPD1和 aPDL1抗体的生物学分析(图1d);
e)CAR+效应细胞是检测aPD1和aPDL1的一个有趣的选择。CAR的胞内结构域通常包含CD3ζ信号结构域,负责激活信号级联反应,类似于完整的CD3复合物(图1e)。据报道CAR-T治疗结合PD1/PDL1抑制子更加有效;
f)T细胞招募型双特异性抗体也可以用于CD3激活(图1f)

图1.CD3激活方法在PD-1/PD-L1相互作用抑制剂生物学分析方法中的应用
由于通过TCR与MHC/peptide复合物的相互作用来激活需要更复杂的技术手段,我们不再深入探讨.
起初选择优化的CD3激活变体用于生物学分析开发,我们比较了可溶性的激活剂,例如αCD3抗体,aCD3/aTAA1,aCD3/aTAA2, 和SEB超抗原(图2),通过两个参数进行评价:绝对激活(包含效应细胞、靶细胞、激活剂和aPD1的系统中的发光强度)和相对激活(系统中的发光强度之比,即在上述系统中含有和不含有aPD1二者发光强度之比)。在含有aCD3/aTAA1和aCD3/aTAA2 激活剂的系统中,发光强度是含有aCD3 和SEB 激活剂系统发光强度的2-3倍。需要注意的是aCD3 和SEB 在本实验中的使用浓度是用于T细胞招募浓度的1000倍和100倍。与上述CD3激活因子不同,可溶性aCD3激活了所有效应细胞,而不仅仅是那些直接与靶细胞相互作用的细胞。当使用PDL1+靶细胞时,PD1介导的CD3依赖性激活的抑制作用仅在某些效应细胞中存在。这造成了背景信号和较低的相对激活。在有aCD3/aTAA1 和aCD3/aTAA2 系统中,相对激活为5-6倍,aCD3 相对激活为1.5倍,SEB系统中相对激活为2倍。因此aCD3 和SEB激活剂相对于T细胞招募剂有较低的绝对激活和相对激活,在后续的研究讨论中排除。而且SEB属于有毒物质,在生物分析中不太受欢迎,如果有其它替代品时要慎用SEB.

图2.可溶性激活剂激活CD3依赖的NFAT信号
有趣的是,在只有效应细胞和可溶性aCD3组成的系统中加入Raji细胞可以提高效应细胞中荧光素酶的表达,这可能是由于aCD3与Raji细胞上Fc受体相互作用的结果.
可溶性CD3活化剂相对于跨膜活化剂分子的一个优点是可以对其浓度进行优化,使体系更加灵活(图3)。在aCD3/aTAA浓度为0.1-1 ng/ ml的范围内,aPD1对荧光强度的影响最大。在我们的实验中,我们使用了1ng /ml的aCD3/aTAA浓度,这提供了最大的相对激活和最大的亮度绝对值。
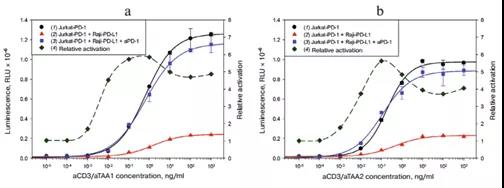
图3.依赖于aCD3/aTAA的两种变体的激活系统
此外,我们比较了四种生物测定法,每一种都基于一种激活方法:aCD3/aTAA的两种变体、跨膜aCD3的靶细胞和CAR+ 的效应细胞(图4)。在含有CAR+效应细胞的系统中,绝对激活高出其它激活形式的5倍。两种aCD3/aTAA变体的相对激活是跨膜激活剂的2-3倍。同时,aCD3/aTAA1比aCD3/aTAA2的相对激活度高。基于这些数据,我们选择aCD3/aTAA1激活CD3。

图4.不同浓度aPD-1,不同激活剂激活报告系统
生物测定表征
为了证明所开发的生物测定法的特异性,我们用aPD1、aPDL1、aCTLA4和aHER2进行了检测(图5)。在本生物实验中CD3依赖激活的抑制是通过效应细胞和靶细胞上分别存在的PD1和PDL1来保证的。NF-AT调控的荧光素酶的表达,是在加入aPD1 或aPD-L1 重激活效应细胞而实现的,aCTLA4 或 aHER2 不能实现效应细胞的重激活。样品的发光强度与抗体浓度的关系可以用四参数逻辑斯蒂方程来描述,这使得比较被测样品的EC50值成为可能。

图5.报告系统特异性验证
为了确定所开发的生物测定法鉴别不同活性的PD1/PDL1抑制剂的能力,我们使用了aPD1和aPDL1两种承受热应力的制剂(图6)。我们观察到EC50值与处理温度之间的直接依赖关系。因此,本发明的生物测定法可以鉴别活性不同的aPD-1和aPDL-1制剂,并可用于其稳定性的测定。
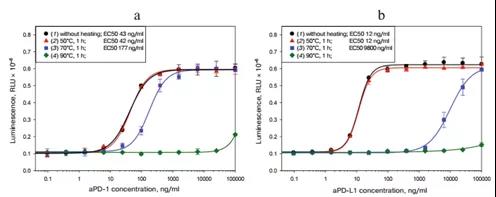
图6.不同活性抗体对报告系统特异性验证
只有在生物测定线性范围内,才能确定被测制剂的正确活性。为了确认该生物测定的范围在50%-200%内,以标准值100%激活为基准,设置aPD-1 和 aPD-L1 在预测标准值50,70.100,140,200% 5个浓度值激活该系统,测定发光强度(图7)。实验结果表明,这些制剂的活性接近预期值。该系统在aPD-1和aPDL-1标准的50-200%的活性范围内是线性的。
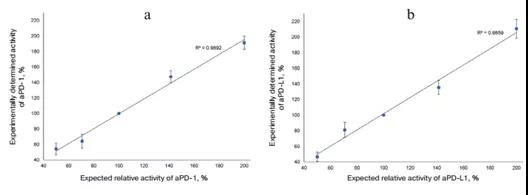
图7.报告系统的线性范围
我们开发了一种生物测定法来评价aPD-1和aPDL-1的生物活性。生物测定包括三种成分(图8):(i)在表面呈现PD1的效应报告细胞系,其基因组中含有NF-AT反应元件启动子控制下的萤火虫荧光素酶报告基因;(ii)表面存在PD-L1的细胞系;(iii)双特异性aCD3/aTAA抗体,用于激活报告细胞系中CD3依赖性NF-AT 信号,并将报告细胞与配体提呈细胞结合。
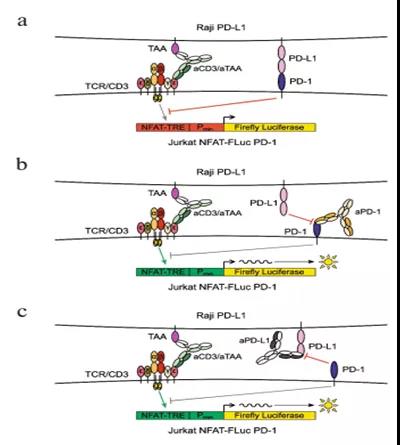
图8.基于双特异性T细胞招募抗体的生物学分析报告系统
我们比较了不同的CD3激活途径,并在实验中发现,当使用T细胞招募抗体作为CD3激活剂时,aPD-1添加后的相对激活最大(图2和图4)。T细胞招募抗体的其他优点是:低背景信号(相对于aCD3),没有额外的基因工程操作(相对于CAR和tmaCD3),并且没有毒性(相对于超抗原)。
值得注意的是,T细胞中CD3激活的两个被考虑的变体——双特异性aCD3/aTAA和CAR ,这是以前在测试PD1/PDL1抑制剂时没有描述过的原始方法。早前报道了基于跨膜aCD3的aPD1或aPDL1活性评价系统。然而,这种方法是有专利保护的,使用范围有限。我们开发了可以在aPD-1和aPDL-1开发阶段使用的生物测定法,用于候选分子的比较和稳定性评估,以及对许多治疗性制剂的表征,以确认它们的等价性,即,通常情况下,80-125%的标准抗体活性,线性范围符合预期。
开发的生物测定方法可以进一步改进,例如,通过使用不稳定的荧光素酶来降低背景信号。
所提供的关于不同的激活剂激活CD3的数据可以用于开发新的治疗试剂和检测方法。
我们已经成功地将所开发的分析方法用于aPD-1和aPDL-1候选治疗药物的选择和表征,目前正在进行临床试验。
如涉及知识产权请与我司联系
|