来源:华人抗体
近年来,双特异性抗体基于更为全面药物机理,显示更强临床及市场前面,成为全球抗体药物的关注的热点。目前全球已批准3个双特异性抗体药物(一个退市),截止到2019年底约有85个项目处于临床阶段,120个左右的项目处于临床前。
按治疗领域分类,75%左右的双抗项目为抗肿瘤药物,以CD3相关的双特异性抗体达到了158个,占到一半以上。双抗药物是众所周知的开发难度大,而CD3双抗则是目前临床阶段转化最为成功的双抗药物,甚至直接叫板CAR-T疗法。
2019年6月14日,再生元公布CD3/CD20双特异性抗体REGN1979一期临床结果:在14个患者中,滤泡淋巴瘤FL患者(5mg以上剂量)总响应率ORR为93%,完全缓解率CR为71%;弥漫大B细胞淋巴瘤DLBCL患者(80mg以上剂量)总响应率为57%(4/7),且均为完全缓解,其中2例为经CAR-T疗法治疗失败的患者。
2019年12月8日,罗氏在ASH会上公布了2款CD3/CD20双抗治疗复发或难治B细胞NHL的良好疗效,在CAR-T治疗无效的患者中也能够产生缓解。在曾经接受过CAR-T疗法的患者中,ORR为38.9%(n=7/18),CR为22.2%(n=4/18)。
2019年ASH期间,基于多个CD3双抗的显著进展,甚至有人提出可以忘记CAR-T药物研发的论断了。然而对于CD3双抗来说,虽然开发有所突破,但也有难度,仍然在摸索中前线。
CD3双抗的研究热点
目前CD3双抗的研发主要集在CD3抗体本身的优化,对于其种属相关性、亲和力和价键方面进行了诸多探索,对于与疗效和副作用进行了充分平衡。
CD3抗体对CD3复合体ε链的亲和力是BsTCEs是否成功的首个关键因素,这一点已经达成行业内共识,维持在1-100nM范围内为最佳。一方面是由于,为了模拟出T细胞的激活作用,CD3抗体需要相对低的亲和力,较高的Koff值。因为T细胞在体细胞的激活过程中,是依靠于T细胞的反复结合进行瀑布效应,形成成簇的T细胞,指数式地带动下游信号通路的变化。如果CD3抗体的亲和力过高,则只会与T细胞形成1:1的结合,很难引起群体T细胞的杀伤作用。另一方面则与组织分布有关,过高亲和力的CD3抗体可能将把双抗限制在脾脏等部位,难以接触到肿瘤。
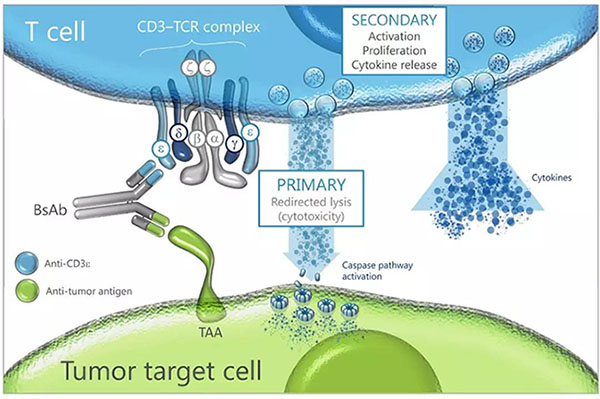
▲CD3双抗药物机理
CD3单抗的种属相关性对CD3双抗的开发极为关键,SP34是目前为数不多公开的可以和猴子具有种属反应的CD3抗体。基于这些因素大型药企及双抗平台型企业均开发了自主的CD3抗体,近年来闪亮登场的WuXibody就拥有自主知识产权可以和猴子具有种属反应的CD3抗体。
CD3价键对于双抗功能也具有重要影响,在研BsTCEs单价CD3形式多价形式的。这主要是在之前的实验过程中,发现多价形式的CD3双抗可能会引起活化诱导T细胞死亡(AICD),造成非靶点依赖的T细胞激活,在没有结合肿瘤相关抗原情况激活T细胞引起副反应。CD3价键同样对于CD3抗体亲和力息息相关,对于单价CD3抗体而言,如上所述通常需要低亲和力的CD3抗体。而对于多价形式,则需要对肿瘤相关抗原具有高亲和力。
CD28为CD3双抗注入活力
基于以上对于CD3双抗的研发方面,是否能否从其他方面取得突破,赛诺菲首先给出了答案。2019年11月18日,在Nature cancer上的一篇报道,来自赛诺菲的研发者们通过CD3双抗联合CD28的三特异性抗体疗法,在抗肿瘤研发取得突破进展。
在T细胞的激活过程中,需要TCR/CD3结合到MHC-多肽,同时需要第二重共刺激信号进一步激活。因而在CD3双抗基础上,激活CD28有望进一步提升抗肿瘤活性。赛诺菲因此传统CD3双抗的基础上加入CD28,形成同时靶向CD38/CD3/CD28的三特异性抗体。
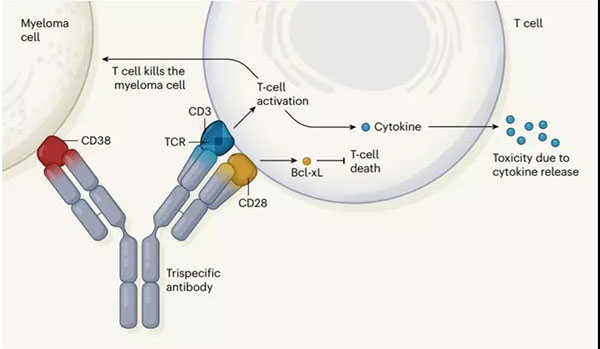
▲CD28三特异性抗体设计原理
从功能上来看,三特异性抗体分工明确。CD38为肿瘤表面抗原,其也可以是其他肿瘤相关抗原,用于特异性识别识别肿瘤细胞;CD3作为T细胞共受体,用于激活细胞毒性T细胞和T辅助细胞,并介导T细胞对肿瘤细胞特异性杀伤;CD28分子则是TCR/CD3复合物的共刺激分子,促进T细胞活化,且这种增强的T细胞活化驱动了T细胞的增殖以及T细胞中抗凋亡蛋白Bcl-xL的表达。
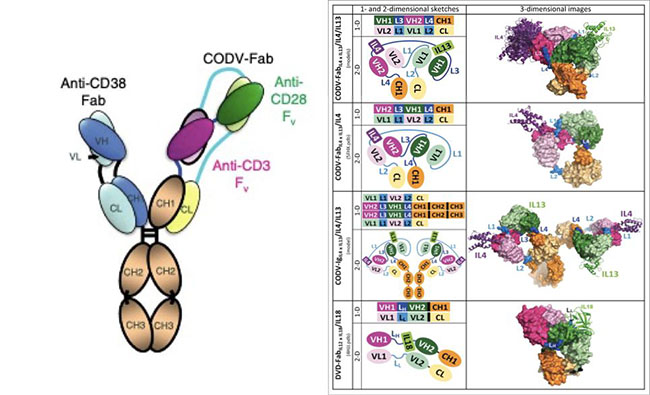
▲基于CODV技术的三特性抗体
在具体的分子结构设计上,其一侧的N端为靶向肿瘤抗原的Fab,另一侧的设计则是通过CODV(cross-over dual variable )双抗技术平台同时靶向CD3/CD28。CODV双抗平台技术最早见于赛诺菲在2016年在mabs上所发表文章,经过不同的排列组合、筛选和评估,确定通过4个linker对VL1/VL2/VH1/VH3以及恒定区进行串联。该结构能够形成良好的空间结构,不同靶点之间的识别不会相互干扰,并且具有较好的稳定性。
在CD3分子亲和力的选择上,采用了中等亲和力的抗体(KD~20nM)平衡了杀伤有效性以及细胞因子大量释放的安全性问题。在Fc的设计上,其采用了IgG4亚型并进行了F234A L235A (FALA) 位点突变,进一步降低了与FcR的结合功能。
在体内外试验,三特异性抗体表现出非常优异的肿瘤杀伤效果,并且在CD38低表达的肿瘤细胞上也具有出色效果。更重要的是,还增强了T细胞在体内外杀伤不同骨髓瘤细胞系的能力。
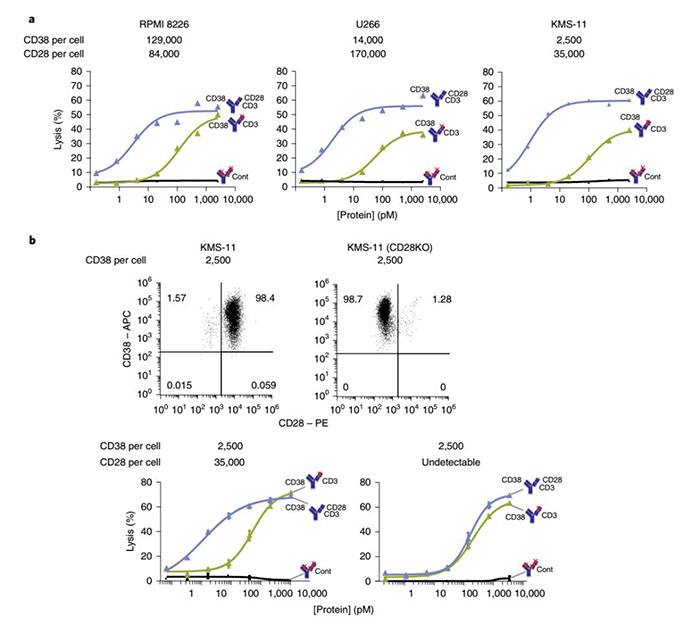
▲CD28三特异性抗体在体外作用
CD28是否会改变双抗的格局?
就在赛诺菲研究工作公布不久后,再生元也尝试了CD28的三抗应用于卵巢癌抗原MUC16和前列腺癌抗原PSMA,一时间共刺激CD28三抗似乎有望成为打破CD3双抗格局的切入点。
CD28三抗能否异军突起?免疫疗法领域的大牛Carl H. June及其同事,在赛诺菲研究的同期的杂志中也进行了观点点评,他认为整体上利用三特异性抗体来治疗癌症是一项重要进展。作为一种灵活的技术,三特异性抗体可被用于靶向免疫调节信号的不同组合,使用这类抗体抗癌可能比多个免疫调节单抗的联合用药更安全、更有效。未来三特异性抗体有望为抗癌免疫治疗提供一条新出路。但和CAR-T药物类似,CD28激活后细胞因子释放综合征(CRS)带来的安全性问题仍需关注。同时这类分子在体内是否会产生免疫原性,带来药物快速被清除的问题也是未来需要探讨的。
在赛诺菲的研究中,当给猴子静脉注射三特异性抗体时,虽然出现了到一定程度的细胞因子相关毒性,但令人欣慰的是,包含CD28结合域的这一分子并没有导致“无法应付”的CRS。然而需要注意的,猴子中的CD38数量远远低于多发性骨髓瘤人类患者,而更多的CD38以及更强的抗体介导的T细胞激活可能会增加人类患者的CRS风险。
确实,虽然CD28助力CD3双抗取得一定的突破,但CD28单抗的TGN1412惨案仍然历历在目。2005年,欧洲药品管理局批准TeGenero公司研发的一款CD28抗体TGN1412进入人体临床试验。2006年3月13日,TGN1412开始首次临床试验。六名健康男性志愿者在英国北威克医院静脉注射了0.1 mg/kg的药物。接下来的几个小时内,全部志愿者都发生了严重的全身性炎症反应,被送往ICU,其中4名发生多器官衰竭。副作用来源于TGN1412诱导的快速和大量的释放细胞因子。
看来关于CD28三抗的研究争论仍将持续,而基于联合疗法的快速兴起,双抗已经不能满足人们的遐想,更广泛的三抗或者多抗疗法或许正在路上了。
值得注意的是,将于2020年5月3日在波士顿举行的华人抗体协会第四届年会中,我们将特别邀请到赛诺菲的首席科学官Gary J. Nabel 博士作为Keynote speaker,带来“Tackling AIDS and Cancer with Novel Antibody Therapeutics”的演讲,分享三特异性抗体在艾滋病及癌症中的应用进展,详细介绍CODV多特异性技术平台。
Gary J Nabel

Gary J. Nabel, M.D., PH.D.
Chief Scientific Officer & Senior VicePresident
Global Research & Development at Sanofi
Dr. Gary J.Nabel M.D., Ph.D. is Chief Scientific Officer, Global Research and Development,and Senior Vice President for Sanofi. Dr. Nabel also oversees the Breakthrough Laboratory at Sanofi, which developed the first trispecific antibodies now in development for HIV, as well as, cancer immuno-therapies and novel vaccines.
An author ofmore than 475 scientific publications, Dr. Nabel joined Sanofi in 2012 from the National Institutes of Health, where he served as Director of the Vaccine Research Center (VRC) since 1999, during which time, he provided overall direction and scientific leadership of the basic, clinical, and translational research activities and guided development of novel vaccine strategies against HIV, universal influenza, Ebola and emerging infectious disease viruses. His work encompasses basic mechanisms of HIV gene activation, structure-based vaccine design, and immunotherapy.
Dr. Nabel graduated magna cum laude from Harvard College in 1975 and continued his graduate studies at Harvard, completing his Ph.D. in 1980 and his M.D. degree two years later, followed by a post-doctoral fellowship with David Baltimore at the Whitehead Institute of MIT. In recognition of his expertise at the forefront of virology,immunology, gene therapy, and molecular biology, Dr. Nabel was elected to the National Academy of Medicine in 1998. Among his many other honors, Dr. Nabe lreceived the Amgen Scientific Achievement Award from the American Society for Biochemistry and Molecular Biology, the Health and Human Services Secretary’s Award for Distinguished Service, and is a fellow of the American Association of Physicians, and the American Academy of Arts Sciences.
如涉及知识产权请与我司联系
参考文献
1.CODV-Ig, a universal bispecific tetravalent and multifunctional immunoglobulin format for medical applications;
2.Trispecific antibodies enhance the therapeutic efficacy of tumor-directed T cells through T cell receptor co-stimulation;
3.Trispecific antibodies offer a third way forward for anticancer immunotherapy
|