来源:联川基因
Abstract
“肿瘤免疫检查点阻断”是指使用治疗性抗体,破坏负免疫调节检查点,并激活预先存在的抗肿瘤免疫反应。通过靶向几种检查点分子,如细胞毒性T淋巴细胞抗原4 (CTLA4)、程序性细胞死亡蛋白-1 (PD1)和PD1配体1 (PD-L1)的抗体已经在临床上取得了初步成功,鉴于此,美国食品和药物管理局(FDA)批准了几种癌症类型的多药制剂。然而,临床医生仍然只有非常有限的工具来区分那些对治疗有反应和没有反应的患者。而且越来越多的临床证据表明,相当比例的最初反应者最终在数月或数年后复发,出现致命的耐药性疾病。这激起了一波研究肿瘤对免疫检查点阻断的内在抵抗的分子机制的浪潮,导致抗肿瘤免疫的关键生物学过程的重新发现,即干扰素信号和抗原递呈。其他的研究努力阐明常规的影响癌症的免疫信号通路,如WNT-β-catenin信号、细胞周期调控信号,丝裂原激活蛋白激酶信号和肿瘤抑制基因PTEN失活的途径。这篇2020年1月发表于《Nat Rev Immunol》的文章回顾了这些耐药的分子机制,以及免疫耐受微环境形成的生物学过程,并探索正在进行的方法来克服对免疫检查点抑制剂的耐药性,并扩大可受益于免疫检查点抑制剂的患者的范围。
Introduction
癌症免疫治疗是利用人类免疫系统的细胞毒性潜能,特别是肿瘤特异性细胞毒性T细胞来治疗恶性肿瘤的一种策略。在不同类型的癌症免疫治疗中,免疫检查点阻断的影响最为广泛,有几种针对细胞毒性T淋巴细胞抗原4 (CTLA4)或程序性细胞死亡1 (PD1)和配体1 (PD-L1)的抗体被批准用于多种不同的癌症。大量针对其他假定的免疫检查点(如LAG3、TIGIT、TIM3、B7H3、CD39、CD73和腺苷A2A受体)的抗体和小分子干扰肿瘤细胞与T细胞、髓细胞与T细胞之间的负调控,正处于临床和临床前的研究中。
患者内在因素(如年龄、性别、HLA基因型和基因多态性),肿瘤内在因素(如宿主免疫系统和肿瘤基质)和环境因素(如肠道微生物群)都可能导致免疫检查点阻断的成功或失败。然而,肿瘤细胞内在因素(这里定义为肿瘤内在因素),与肿瘤细胞本身的遗传、转录或功能特征有关,是对药物敏感和耐药的主要决定因素。肿瘤内在因素的重要性反映在不同组织学类型的免疫检查点阻断反应率的广泛差异,以及具有相似分子和遗传特征的肿瘤的高反应率(例如,微卫星不稳定性)。这些肿瘤的内在因素也会影响一些肿瘤细胞的外在因素(如宿主免疫系统和肿瘤相关基质)参与肿瘤治疗临床耐药。
在这篇综述中,作者着重于肿瘤的内在因素对免疫检查点阻断的耐药性。并回顾了肿瘤对免疫检查点阻断反应的免疫学基础,重点介绍了关键的生物标志物,并讨论了这些标志物是如何反映促进对免疫检查点阻断反应的肿瘤内在因素的。同时,作者研究肿瘤固有缺陷导致免疫检查点阻断的机制,并强调现有的和正在出现的克服肿瘤固有耐药机制的方法。
一、肿瘤内在的抗性机制
决定自然产生的抗肿瘤T细胞反应的诱导和维持的因素是复杂的。肿瘤细胞自身固有的特征,如肿瘤细胞突变谱,干扰素信号通路的功能,抗原递呈分子的表达和免疫逃逸的致癌信号通路等,都会影响T细胞对肿瘤微环境的启动、活化和募集,这个过程是在免疫检查点阻断的情况下,对免疫应答所必要的。同样地,对免疫检查点阻断的抵抗力可能是由这些关键肿瘤特征的破坏所引起的,可以通过预防从头进行的抗肿瘤免疫反应或通过抵消正在进行的抗肿瘤反应来实现。
二、肿瘤的抗原性不足
多项研究表明,肿瘤新抗原有可能成为抗肿瘤免疫的有效靶标,而且突变负荷与跨恶性肿瘤对免疫检查点阻滞的反应之间存在相关性。在对抗CTLA4免疫检查点阻断有反应的患者中,已显示对特定肿瘤新抗原具有特异性的T细胞先前已存在于肿瘤微环境中,并在抗CTLA4疗法的反应下扩增。在小鼠甲基胆碱诱发的肉瘤模型中,针对新抗原的T细胞可扩展并获得抗肿瘤功能,以应对免疫检查点阻断。在没有免疫检查点阻断的情况下,甚至可以在肿瘤微环境中检测到强新抗原特异性T细胞。在患有转移性胆管癌的患者中,肿瘤浸润淋巴细胞带有对肿瘤新抗原具有特异性的CD4 + T细胞群。过继转移富集的突变特异性T细胞导致有效的抗肿瘤反应。越来越多的证据,包括正在进行的基于新抗原的肿瘤疫苗研究的早期结果表明,新抗原是关键的癌症免疫原。因错配修复缺陷而导致微卫星不稳定的患者对免疫检查点阻断的反应率较高的观察结果进一步支持了新抗原在抗肿瘤免疫反应中的作用。相反,抗原性差的肿瘤不太可能对免疫检查点阻断具有内在敏感性。
三、肿瘤固有白介素-γ信号通路
针对肿瘤抗原的有效T细胞反应导致肿瘤微环境中干扰素γ(IFNγ)的表达,从而激活JAK和STAT信号转导,从而诱导PD-L1表达。肿瘤细胞对IFNγ信号的反应中断可阻止PD-L1表达的诱导,从而使PD1/PD-L1阻断无效(图1)。然而,早就知道破坏肿瘤细胞对IFNγ信号传导的反应不仅是对免疫检查点阻断的抗性机制,而且更广泛地是对抗肿瘤免疫的抗性机制。经过工程改造以表达显性阴性IFNγ受体的小鼠肿瘤表现出更大的致瘤性,并且对通过全身性给予脂多糖引起的抗肿瘤免疫具有抵抗力。这些肿瘤也可以在对亲代肿瘤具有事先免疫力的小鼠体内建立。当在缺乏IFNγ受体的小鼠中出现的自发性肿瘤被重新植入具有免疫能力和免疫缺陷的小鼠中时,它们以相似的动力学生长。但是,这些肿瘤中IFNγ受体的重组导致它们在具有免疫能力(但不是免疫缺陷)的小鼠中被排斥,这突显了肿瘤固有的IFNγ信号通路在免疫排斥中的关键作用(图2)。
与IFNγ受体信号传导在调节肿瘤的免疫原性中的作用相反,还提出了肿瘤细胞中的长期IFNγ受体信号传导可以介导对免疫检查点阻断的抗性。这是基于抗病毒免疫的概念,其中长时间暴露于I型干扰素信号传导会对病毒控制产生有害影响。一项研究表明,小鼠黑素瘤细胞在体外或体内长期暴露于IFNγ会导致PD-L1依赖性机制,其机制是通过上调替代性T细胞抑制性受体来实现对免疫检查点阻断的适应性抵抗,这是与IFNγ信号有关的表观遗传和转录组变化,尤其是STAT1。正在进行JAK抑制剂与抗PD1检查点阻断剂结合的临床研究(NCT02646748和NCT03012230),但早期结果并不令人满意。
尚不清楚IFNγ信号传导的下游功能中的哪一个对免疫检查点阻断的成功最关键。IFNγ信号传导具有直接的抗增殖作用,导致抗原加工机制与表面MHC I类和II类分子的协同表达,并导致化学引诱剂如CXCL9和CXCL10的表达(图2,3a)。源自人类黑色素瘤的细胞系在IFNγ信号传导中具有固有的遗传缺陷,不再对其抗增殖作用敏感,也不再上调MHC I类分子。
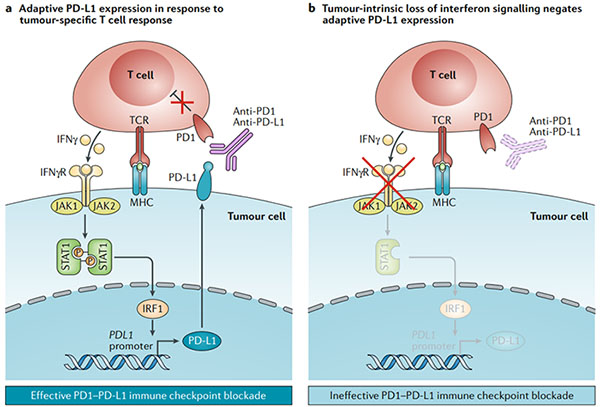
图1.干扰素信号转导自适应程序性细胞死亡1配体1表达
预先存在的抗肿瘤免疫反应是有效的免疫检查点阻断的关键。在MHC I类或II类背景下识别肿瘤新抗原的肿瘤反应性T细胞释放干扰素γ(IFNγ),从而导致Janus激酶(JAK)信号转导子和转录激活子(STAT)信号通路的激活。这激活了转录因子干扰素调节因子1(IRF1),然后激活了PDL1的转录。这导致肿瘤细胞表面上程序性细胞死亡1配体1(PD-L1)的适应性表达,从而负调节抗肿瘤T细胞反应。针对PD1或PD-L1的抗体破坏了这种负反馈回路,以恢复抗肿瘤免疫力。b.类似的情况是,在MHC的情况下,肿瘤特异性T细胞遇到抗原,导致IFNγ释放。然而,由于IFNγ信号传导途径中的遗传缺陷(例如影响JAK1或JAK2),因此肿瘤细胞不会传递IFNγ信号,并且不会发生适应性PD-L1表达。在缺乏适应性PD-L1表达的情况下,PD1 PD-L1免疫检查点阻断无效。IFNγR,IFNγ受体;TCR,T细胞受体。
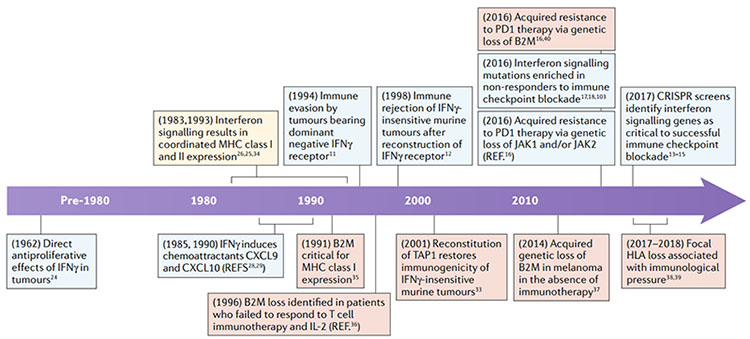
图2.干扰素-γ(IFNγ)途径和抗原呈递在抗肿瘤免疫中的重要发现时间表
四、肿瘤固有的MHC缺失
肿瘤细胞可以通过下调表面MHC表达来逃避T细胞的杀伤。由于肿瘤抗原呈递主要通过I类MHC途径发生,因此与II类MHC抗原呈递缺陷相比,该途径的缺陷更为常见。然而,已经有人提出,黑色素瘤细胞上II类MHC的表达可能是抗PD1治疗反应的生物标志物,并且可能受一组独特的耐药机制支配。
IFNγ信号传导在抗肿瘤免疫中的重要作用可能与它诱导或增强MHC I类抗原呈递的事实有关,这一过程需要几个基因的协同表达,包括TAP1,TAP2,B2M和免疫蛋白酶体基因PSMB8,PSMB9 和PSMB10(图3b)。对干扰素信号传导缺乏敏感性的肿瘤细胞可能很少或没有MHC I类抗原呈递,从而允许免疫逃逸。在2001年的一项研究中,将TAP1稳定转染到IFNγ缺陷的肿瘤细胞中导致它们在野生型但不是T细胞缺陷(Rag2- /)小鼠中被排斥(图2)。确实,某些MHC I类缺陷的肿瘤细胞需要用IFNγ预处理以协调表达抗原加工机制和MHC I类肽复合物。
即使在存在IFNγ信号的情况下,抗原加工设备中的缺陷也会破坏MHC I类表面表达(图2,3b)。具有这种突变的肿瘤不仅对T细胞介导的免疫疗法有抵抗力,而且这些突变实际上可能是免疫系统选择性压力的结果。例如,据报道接受免疫治疗的黑色素瘤患者可能会失去β2-微球蛋白的功能性表达(B2M;从而丧失MHC I类表达)(图2)。另一名转移性黑色素瘤患者的纵向活检标本显示,在缺乏免疫疗法的情况下,由于B2M丢失,导致获得了MHC I类缺陷。最近的一种计算HLA拷贝数的计算方法允许研究人员推断HLA基因座的克隆和亚克隆杂合性丧失的程度,杂合性事件的平行,亚克隆和局灶性HLA频繁丢失,在转移部位富集,表明存在免疫学压力即使不进行免疫治疗,在这些肿瘤中也存在。微卫星不稳定的结直肠癌患者具有很高的免疫原性,在免疫压力和抗原加工机器的基因改变之间也有类似的关联。
毫不奇怪,已经报道了几例获得性抵抗免疫检查点阻断的耐药性的案例,这些案例中编码抗原加工机制的基因特别是B2M发生了突变。此外,B2M基因座杂合性的丧失与接受免疫检查点阻断治疗的两个独立的黑色素瘤患者队列的总体存活率降低相关。还已经确定了调节抗原呈递的新基因。例如,体外功能获得性激酶组筛选显示,编码HLA-A转录后负调节剂的MEX3B,可使黑素瘤细胞逃避肿瘤特异性T细胞(图3b)。值得注意的是,抗PD1治疗后MEX3B表达丰富了无反应的患者人群。
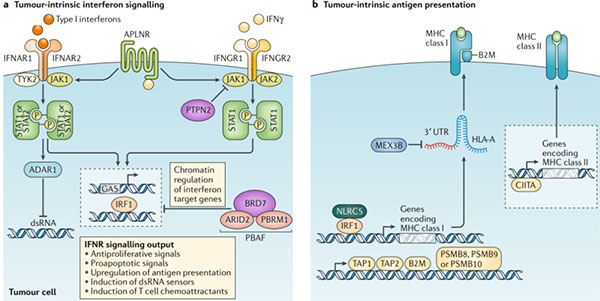
图3.抵抗免疫检查点阻断:肿瘤内在逃逸机制
a.多个无偏倚的基于CRISPR的筛选发现了肿瘤内源性干扰素信号传导对免疫检查点阻断和基于T细胞的免疫疗法的关键作用。这些研究已经确定了干扰素-γ(IFNγ)和I型干扰素信号传导途径的组成部分。例如Janus激酶1(JAK1),JAK2,信号转导和转录激活因子1(STAT1)以及IFNγ受体I(IFNGR1)和IFNGR2对免疫检查点阻断的成败至关重要。这项研究还确定了鲜为人知的调节剂对免疫检查点阻断反应的作用,包括表面受体apelin受体(APLNR),该受体调节上游对IFNγ和I型干扰素信号传导,酪氨酸蛋白磷酸酶非受体2型(PTPN2)的敏感性。它调节对IFNγ信号,BRD7和DNA结合亚基ARID2和PBRM1的上游敏感性,它们是染色质重塑复合物PBAF的一部分,并参与IFNγ靶基因的调控。以及双链RNA(dsRNA)特异的腺苷脱氨酶(ADAR1),它对内源性dsRNA含量有负调节作用。I型干扰素和IFNγ信号在DNA中的IFNγ激活位点(GAS)上会聚,并激活转录调节因子,如干扰素调节因子1(IRF1),然后驱动干扰素信号传导的关键输出。
b.大量研究表明,抗原呈递中与干扰素无关的缺陷也会导致免疫逃逸和对免疫检查点阻断的抵抗。这些缺陷可能发生在HLA基因座或MHC I类复杂成分β2-微球蛋白(B2M)中。其他缺陷可能会在抗原加工机制中发生,例如膜结合转运蛋白TAP1和TAP2以及免疫蛋白酶亚基PSMB8,PSMB9或PSMB10,或者在MHC I类的转录调控中(例如细胞质蛋白NLRC5)。MHC I类表达也可能在转录后水平受到影响。RNA结合蛋白MEX3B可以结合HLA-A转录物,导致其降解并降低MHC I类分子的表达。发现对检查站阻断无反应的黑色素瘤患者MEX3B上调。尽管在肿瘤细胞上更高的MHC II类抗原呈递与对免疫检查点阻断的改善反应相关,但在对免疫检查点阻断产生抗药性的情况下,尚未发现MHC II类基因或MHC II类转录激活因子CIITA的遗传缺陷。IFNAR1,干扰素-α和β受体亚基1;IFNR,干扰素受体;UTR,非编码区。
五、由致癌信号通路调节
致癌信号通路可能与癌症发展各个阶段的肿瘤免疫力有关,包括肿瘤起始,生长,侵袭和转移。这些肿瘤内在途径在塑造肿瘤免疫原性和免疫微环境中的作用最近在其他地方综述了。在这里,我们着眼于三种途径,这些证据支持在肿瘤内源性对免疫检查点的抗性中发挥作用,从而阻断了WNT-β-catenin途径,细胞周期蛋白依赖性激酶4(CDK4)-CDK6途径和有丝分裂原激活的蛋白激酶(MAPK)途径, 以及PTEN丢失引起的途径。
WNT-β-catenin信号传导。WNT-β-catenin信号传导是一种进化保守的信号传导途径,涉及多种细胞过程,包括肿瘤发生和胚胎发生。典型的WNT-β-catenin信号传导是通过WNT家族蛋白与细胞表面受体的结合而启动的,从而激活信号转导,从而导致β-catenin的核转位和转录激活。最近,它已成为一种致癌信号通路,阻碍了从头抗肿瘤免疫反应的启动。这种观点是从一项观察发现的,即具有活跃的WNT-β-catenin信号传导的黑色素瘤样本中约有三分之一缺乏明显的T细胞浸润。具有活跃WNT-β-catenin信号传导的黑素瘤细胞系可产生免疫抑制细胞因子,例如IL-10。最近,研究表明,体内黑色素瘤细胞产生的WNT-β-catenin信号传导可通过破坏表达碱性亮氨酸拉链转录因子ATF-like 3(BATF3)的树突状细胞的募集而阻止引发抗肿瘤反应。其他研究表明,源自黑素瘤细胞的可溶性WNT激动剂WNT5A可以激活树突状细胞中的β-catenin信号传导,从而导致代谢向氧化磷酸化和脂肪酸氧化的转变,其特征在于吲哚胺2,3-二加氧酶1(IDO1)和过氧化物酶体增殖物激活受体-γ(PPARγ)分别促进免疫抑制。具体而言,色氨酸向犬尿氨酸的转化是由IDO1催化的,IDO1是WNT5A诱导的信号传导下游的转录靶标。这种代谢转变促进了调节性T细胞的发育,同时抑制了效应T细胞的活性。在Braf V600E / Pten-//小鼠黑素瘤模型中,抑制这种代谢变化可增强抗PD1免疫疗法的功效。
一系列针对几种不同类型癌症的研究表明,增强的WNT-β-catenin信号传导与缺乏内在免疫细胞浸润的肿瘤之间存在联系,而内在免疫细胞浸润对免疫检查点阻滞反应的可能性较小(也称为免疫学上的冷肿瘤)。这项研究包括一项整合了《癌症基因组图集》中来自结直肠癌的基因组,转录组学和免疫组化数据的研究,以及其他有关免疫性冷卵巢癌,头颈癌,膀胱癌和腺样囊性癌的研究。另一项研究鉴定了丝氨酸/ 苏氨酸蛋白激酶PAK4(一种WNT信号介导物)可丰富黑色素瘤患者的免疫性冷肿瘤,对抗PD1免疫检查点阻断无反应。在多种小鼠模型中,PAK4的基因缺失或药理抑制导致对抗PD1治疗的耐药性逆转。
CDK4-CDK6与细胞周期有关。早期的证据表明细胞周期调控与致癌转化之间存在联系,这是通过观察到细胞周期蛋白A基因座上病毒整合与病毒整合,腺病毒致癌基因E1A与细胞周期蛋白A的关联以及D型细胞周期蛋白在甲状旁腺肿瘤中的过度表达而观察到的。CDK4和CDK6与肿瘤发生特别相关,因为它们与D型细胞周期蛋白一起促进细胞周期从G1期发展到S期。被发现的十年后,小分子palbociclib成为第一个获得美国食品和药物管理局批准的CDK4 / CDK6抑制剂。自2017年以来,至少有四项研究强调了CDK4 / CDK6抑制对抗肿瘤免疫的影响。例如,研究表明,CDK4 / CDK6抑制剂abemaciclib与抗PD-L1疗法联合使用具有更大的抗肿瘤作用。在小鼠乳腺癌模型中比单独使用任何一种药物。该观察结果归因于肿瘤细胞增加的双链RNA(dsRNA)分子的产生和感觉,这可能是由于对药物的反应中DNA甲基转移酶水平降低所致。肿瘤细胞通过模式识别受体的表达识别诸如dsRNA之类的危险信号,从而导致促炎基因(包括编码干扰素和抗原呈递机制的基因)过表达。在另一项有关人类T细胞,患者来源的离体培养物以及自发和异种移植小鼠癌症模型的组合研究中,palbociclib或trilaciclib与抗PD1阻断剂的组合比单独使用任何一种药物更有效。在这里,CDK4 / CDK6抑制作用对抗肿瘤免疫力的影响主要归因于它们对T细胞的直接影响,尽管降低了它们的增殖能力,但导致更大的IL-2产生和增加的肿瘤浸润。考虑到CDK4 / CDK6在T细胞功能中的作用,CDK4 / CDK6抑制抗肿瘤免疫的作用是否受到对肿瘤细胞致癌信号的直接影响,可能取决于每个模型系统中CDK4 / CDK6的相关性。
来自接受免疫检查点阻断治疗的患者的黑色素瘤样品的单细胞转录组研究确定了由CDK4 / CDK6驱动的耐药性程序。利用来自癌症基因组图谱黑素瘤队列的大量RNA测序数据,鉴定了与T细胞排斥相关的肿瘤细胞的基因表达特征,该基因表达特征与富含对免疫检查点阻断具有抗性的肿瘤的基因重叠。研究作者称这种重叠基因设定了抗药性计划。表达抗性程序的细胞系的药理学筛选发现它们对CDK4 / CDK6抑制剂敏感。此外,在先前用于研究CDK4 / CDK6抑制作用对乳腺癌细胞和小鼠模型的影响的数据集中,抵抗程序因对CDK4 / CDK6抑制作用而受到抑制。CDK4 / CDK6通过使肿瘤抑制性视网膜母细胞瘤相关蛋白1(RB1)磷酸化而起作用,与此相一致,CDK4 / CDK6抑制抑制了两种RB充足的黑素瘤细胞系中的耐药性程序,但在RB不足的黑色素瘤细胞系中却没有。
MAPK信号传导。MAPK信号通路可通过增加免疫调节细胞因子IL-6和IL-10的表达在癌症免疫逃逸中发挥作用。该信号通路对肿瘤免疫状态的影响在黑色素瘤中尤为重要,其中约一半的肿瘤携带MAPK BRAF突变,BRAF-V600E激活突变,而免疫检查点阻断是一线治疗。维拉非尼是BRAF突变的抑制剂,已显示出可增加黑色素瘤细胞对T细胞的细胞毒性作用的敏感性,而不会影响T细胞的增殖能力。
vemurafenib还可以通过依赖于活化突变BRAF-V600E的方式通过IFNγ受体和肿瘤坏死因子受体的协同信号传导诱导细胞周期停滞。为了支持这一发现,较早描述的与肿瘤特异性T细胞共培养的B16肿瘤细胞的CRISPR筛选也显示,针对MAPK途径负调控子的CRISPR指导物对抗性肿瘤细胞的富集。在另一项使用PD1阻断治疗的患者的黑色素瘤标本的RNA测序研究中,从没有表现出反应的患者中采集的肿瘤样品鉴定了基因签名,该签名与先前发表的与MAPK抑制剂耐药相关的签名重叠。但是,这些数据必须谨慎评估,因为其他两个大的转录组数据集并不能证实这些数据,这些数据集来自接受免疫检查点阻断治疗的黑色素瘤患者的肿瘤。抑制BRAF还可以破坏免疫抑制因子的肿瘤内在表达。例如,BRAFV600E肿瘤显示出细胞因子IL-6,VEGF和IL-10的表达增加,它们具有免疫抑制功能,部分原因是它们对树突状细胞功能的影响(例如IL-12和肿瘤坏死因子的产生)。
由于与野生型BRAF细胞中MAPK通路的反常激活有关的毒性问题,使用免疫检查点阻断和用vemurafenib抑制突变BRAF与维拉非尼的联合疗法的开发停滞了。相反,研究人员转向使用MAPK /细胞外信号调节激酶激酶(MEK)抑制剂,该抑制剂可抑制BRAF-V600E和野生型BRAF细胞中的MAPK途径,或MEK和BRAF抑制剂的组合。在结肠癌的临床前模型(CT26模型)中,抗PD1治疗与MEK抑制相结合可长期控制肿瘤。同样,MEK和BRAF抑制的组合增强了过继性T细胞疗法和抗PD1阻断的疗效。最近报道了三项结合MAPK信号传导抑制剂和免疫检查点阻滞的临床研究。其中两项研究使用了dabrafenib(一种BRAF抑制剂),trametinib(一种MEK抑制剂)和抗PD1抗体pembrolizumab,两者均观察到高缓解率(63%和73%),以及较高的3级或更高的毒性作用(分别为58%和73%)。第三项研究包括接受cobimetinib(一种MEK抑制剂),vemurafenib和抗PD-L1抗体atezolizumab组合的患者,其中72%达到了客观缓解(完全缓解率为21%)。Cobimetinib和vemurafenib治疗的导入期导致循环增殖CD4 + T细胞水平相对增加。
肿瘤抑制因子PTEN缺失。尽管已经在一个世纪中描述了肿瘤抑制因子在肿瘤发生中的典型作用,但直到20世纪末,才发现PTEN丢失是一种常见的致癌事件。一项研究针对基于T细胞的免疫疗法的功效,严格检查了PTEN缺失在人黑素瘤和黑素瘤同系小鼠模型中的作用。在缺乏PTEN的情况下,无论是在体内还是体外,肿瘤细胞对肿瘤特异性T细胞的细胞毒性作用都更具抵抗力。PTEN表达还与对抗PD1疗法的反应以及患者体内离体扩增的肿瘤浸润淋巴细胞的更成功产量相关。其他研究也观察到了PTEN丢失的类似影响:来自癌症基因组图集软组织肉瘤数据集的RNA测序数据显示,在患有以下疾病的肿瘤中,与T细胞浸润和溶细胞活性相关的基因(例如编码CD8α和粒酶B的基因)的表达下降。PTEN的缺失。此外,在对抗PD1免疫检查点阻滞有部分反应的患者中,发现无反应的病灶具有PTEN74的缺失,表明PTEN缺失可能在抗药性中发挥作用。值得注意的是,PTEN可以通过响应DNA病毒,RNA病毒,多肌苷酸:聚胞苷酸和脂多糖的模式识别受体的激活来辅助干扰素调节因子3(IRF3)的核转运,从而响应病毒刺激来促进I型干扰素信号传导。这可能与使用靶向模式识别受体的新药克服免疫检查点阻滞的抗药性有关。
考虑到PI3K被PTEN负调节并且是癌症中通常失调的激酶,已经提出抑制磷酸肌醇3-激酶(PI3K)作为提高抗肿瘤免疫力的治疗方法。然而,不同的PI3K同工型在癌细胞(PI3Kα和PI3Kβ)和免疫细胞(PI3Kδ和PI3Kγ)中具有活性。尽管抑制富含肿瘤细胞的PI3K同工型可以减少肿瘤的生长,但是大多数支持PI3K抑制在提高抗肿瘤免疫力中起作用的证据都是基于对PI3Kγ或PI3Kδ的抑制。例如,在缺乏功能性PI3Kγ或PI3Kδ的宿主中生长的野生型肿瘤以T细胞依赖性方式减慢了肿瘤的生长。巨噬细胞中的PI3Kγ激活可以激活免疫抑制转录程序,该程序以与肿瘤细胞无关的方式阻止抗肿瘤T细胞功能。然而,肿瘤固有的PI3K抑制作用是否会影响抗肿瘤免疫性尚不清楚。正在进行临床研究(例如NCT02646748),以评估PI3K抑制剂和免疫检查点阻断对实体瘤患者的综合影响。
肿瘤去分化和干细胞化。肿瘤发生或肿瘤干细胞对传统的细胞毒性疗法有抵抗力。已有证据表明,肿瘤的去分化或干性也可能在抵抗基于免疫的疗法中起作用。对抗PD1免疫检查点阻断有抵抗力的黑色素瘤患者的肿瘤进行了转录组学分析,确定了丰富的茎样间充质基因签名。在一名针对过继转移的靶向黑素细胞分化抗原1(MART1)的T细胞有反应的患者中,复发的肿瘤失去了MART1的表达,这是一种脱分化和免疫治疗耐药性的现象,在体外表现出来。其他研究表明,肿瘤启动干细胞可能表达负调控分子,例如CD80,PD-L1(参考文献81)和NKGD2。最后,WNT信号传导(先前被描述为介导免疫疗法抗性的致癌途径)在肿瘤干和去分化中也具有众所周知的作用。
六、肿瘤固有抵抗力的生物标志物
1. 新生肿瘤反应性T细胞
与基于活化的肿瘤特异性T细胞的过继转移的方法不同,免疫检查点阻断可利用自然发生的抗肿瘤T细胞反应。几项观察表明,免疫检查点阻断的功效取决于预先存在的免疫反应。首先,黑色素瘤是一种以其固有的免疫原性而闻名的肿瘤,对免疫检查点阻断单一疗法的反应率很高。黑色素瘤长期以来一直是研究免疫疗法的模型恶性肿瘤,转移性黑色素瘤患者体内离体扩增的肿瘤浸润淋巴细胞的过继性细胞转移的临床成功为黑色素瘤患者存在天然存在的肿瘤特异性T细胞提供了证据。
先前存在的抗肿瘤免疫反应的最简单指标可能是肿瘤微环境中存在T细胞。在接受抗PD1治疗的黑色素瘤患者中,预处理活检标本中T细胞的存在与对治疗的反应相关,和侵入边缘的CD8 + T细胞密度在一个小型验证队列中可预测反应。对PD1阻断疗法有反应的患者的基线标本在浸润边缘也具有较高水平的磷酸化STAT1表达。这表明对治疗的反应不仅需要T细胞的存在,而且还需要产生IFNγ的活化T细胞的存在,这会引发一个信号级联反应,从而导致相邻肿瘤和基质细胞中STAT1的磷酸化。这支持了肿瘤固有的IFNγ信号传导在上述对PD1阻滞的应答中的作用。在患有错配修复缺陷的大肠癌患者中抗PD1治疗(pembrolizumab)的研究和尿路上皮癌患者抗PD-L1治疗的研究中也报告了类似的发现。
但是,这种观察并不普遍。在先前接受过抗CTLA4治疗或未接受抗CTLA4治疗的患者队列中,基线处存在的肿瘤浸润淋巴细胞与抗PD1治疗反应无关,在其他队列中也有例外。这可能部分与用于分析的预处理活检标本的肿瘤异质性和选择偏倚有关。在某些情况下,患者可能携带肿瘤特异性T细胞,但局部免疫抑制因子限制了这些克隆的浸润和扩增。在其他情况下,肿瘤特异性T细胞可能存在于外周,而不存在于肿瘤微环境中。这表明,对于从头抗肿瘤免疫应答的存在,肿瘤浸润淋巴细胞的存在不是特别敏感的替代物。
2. PD-L1作为干扰素信号的标记
在某些而非全部情况下,已显示肿瘤微环境中免疫检查点分子(例如PD-L1)的表达可预测对免疫检查点阻断的反应。但是,PD-L1表达并不一定表明已存在抗肿瘤免疫反应。一些PD-L1阳性肿瘤患者对治疗无反应,一些PD-L1阴性肿瘤患者也可以从免疫检查点阻断中获益。
PD-L1的表达主要受干扰素信号传导途径调节,该信号传导途径包括激酶JAK1和JAK2以及转录因子STAT1,STAT2和STAT3,以及转录激活因子IRF1。IFNγ甚至可以刺激PD-L1在肿瘤来源的外泌体上的表达,这也可以介导CD8 + T细胞的抑制。在这种情况下,肿瘤浸润性T细胞与表达PD-L1的肿瘤和/或免疫细胞共存,阻断PD1 PD-L1轴可能是有效的(图1a),并进一步支持了PD1的作用。肿瘤内源性IFNγ信号传导对PD1阻滞的反应。
I型干扰素信号传导和II型干扰素(IFNγ)信号传导都收敛以激活类似的下游基因靶标,例如PDL1。I型干扰素主要由髓样细胞响应模式识别受体的激活而产生,而II型干扰素主要由T细胞在识别同源抗原时产生。因此,在基于T细胞的抗肿瘤免疫中,II型干扰素起着更为重要的作用。干扰素信号传导途径中的突变(尤其是II型干扰素信号传导)或限制肿瘤特异性PD-L1表达的表观遗传和转录后机制可使PD-1 PD-L1免疫检查点阻断多余。
PD-L1表达也可以通过各种其他机制进行调节。这些机制包括基因过表达(例如PD-L1,PD-L2和JAK2的基因座的扩增,称为PDJ amplicon104),表观遗传沉默,转录调控(例如,通过MYC,PTEN和低氧诱导因子1α),转录后调节(通过microRNA),翻译后修饰(糖基化,磷酸化和泛素化)以及胞质和内体重定位。这些过程也会影响对PD1阻断疗法的反应。
3. 从肿瘤转录组学得到的经验
尽管采用了新兴的多重方法,但基于免疫组化的评估肿瘤免疫状态的方法受到其分析范围的限制。因此,RNA测序和靶向基因阵列已远远超过了它们。这些努力与RNA解卷积算法的进步(例如溶细胞活性评分,MCP计数器,CIBERSORT和TIMER)并行,可以评估大块肿瘤标本的免疫细胞组成。溶细胞活性评分是RNA解卷积技术中最简单的一种,它使用颗粒酶A和穿孔素表达的几何平均值来总结肿瘤的效应T细胞组成。较高的基线溶细胞活性评分与抗CTLA4免疫检查点阻断的反应相关,病毒防御基因表达特征也是如此。
但是,基于大块肿瘤RNA的免疫标记具有缺点。肿瘤异质性是在研究内部和研究之间获得可重复的,一致的结果的障碍。在接受抗CTLA4预处理的一组患者中(未接受过抗CTLA4的未接受过治疗的患者),其细胞溶解活性评分增加,并且抗PD1反应患者的基线肿瘤中病毒防御标记丰富,但没有特定的免疫人群在基线时通过CIBERSORT RNA解卷积鉴定出的蛋白与反应显着相关。在另一组接受抗PD1治疗的患者中,基线溶细胞活性评分或干扰素信号与反应无关。为了克服批量肿瘤转录组学的障碍,单细胞RNA测序工作正在进行中。对来自32位接受免疫检查点阻断治疗的患者的48份肿瘤活检标本进行的分析显示,在有反应的患者的基线标本中CD8 + T细胞浸润(由免疫组织化学定义)没有增加。然而,单细胞RNA测序显示,与CD8 + T细胞相比,应答者的基线标本中的CD8 + T细胞富含与记忆细胞分化(例如,编码转录因子的TCF7),激活和细胞存活有关的转录本。无应答者,富含与疲劳相关的基因。
4. 肿瘤新抗原作为T细胞靶向
尽管有证据表明新抗原特异性T细胞反应是免疫检查点阻断功效的核心,但突变负荷有限,无法预测对免疫检查点阻断反应的反应。这可能部分是由于所讨论的突变的克隆性。在患者的所有肿瘤细胞中共有的克隆突变对于产生有效的抗肿瘤反应可能更为关键。
此外,为了使突变成为免疫学靶标,必须通过MHC抗原有效地将其呈递给免疫系统。尽管新抗原预测工具已得到改进,但缺乏用于验证这些预测工具的高通量检测方法限制了其进展。例如,在接受抗CTLA4治疗的一组患者中,预测的新抗原负荷没有超过突变负荷作为反应的生物标志物。最后,鉴于肿瘤微环境中抗肿瘤免疫反应的其他障碍的存在,新抗原的存在可能是不足的生物标志物。实际上,在多个针对PD1治疗的前瞻性研究中,既捕获了肿瘤内在突变负担又感染了肿瘤微环境的生物标志物与反应的相关性更强,而不是单独使用任何一种生物标志物。
七、克服肿瘤固有抵抗力
与单独使用任一疗法相比,将抗CTLA4和抗PD1阻断剂联合使用所见的优异的抗肿瘤反应表明,这两个免疫学检查要点具有非冗余的分子机制。转录组学和免疫组化数据表明,对双重免疫检查点阻滞的反应者是那些已经存在的生产性抗肿瘤反应,被免疫检查点所抑制的反应超出了PD1 PD-L1和CTLA4的阻滞(图4a)。几种靶向替代性免疫检查点的抑制剂处于临床前和临床开发阶段,包括靶向LAG3,VISTA,TIM3,腺苷A2A受体,CD73,BTLA,B7-H3,B7-H4和杀伤细胞免疫球蛋白样受体的抑制剂。
但是,这使很大一部分患者具有免疫学上较冷的肿瘤,不太可能对单一或联合免疫检查点阻断产生反应。对于这些患者,目的是通过增强抗原呈递和引发针对现有抗原的免疫反应来启动抗肿瘤免疫反应。肿瘤及其引流性淋巴结据称是肿瘤抗原呈递的主要部位,因此调节肿瘤内和淋巴结抗原呈递的肿瘤导向方法引起了人们的兴趣(图4b)。这些方法基于:(1)在肿瘤微环境中诱导压倒免疫抑制基础机制的促炎状态;(2)诱导免疫原性细胞死亡;(3)募集专业抗原呈递细胞(APC)来有效引发针对肿瘤抗原的启动。肿瘤内免疫刺激剂的一个早期实例是卡介苗(Calillus CalmetteGuérin),它是浅表性膀胱癌的标准疗法。
化学疗法和放射疗法都可以通过多种提议的机制诱导免疫原性细胞死亡,这些机制在其他地方有详细介绍。在小鼠模型中,化学疗法和放射疗法的免疫效果均依赖于T细胞,并且两者均可 增强免疫检查站阻断的影响。然而,化学疗法和放射疗法具有充分证明的免疫抑制功能,可诱导对免疫疗法产生耐药性的肿瘤外源性机制。因此,这些标准疗法不太可能作为克服对免疫检查点阻断的内在抗性的主要方法出现,但是它们在控制疾病负担和引发免疫原性细胞死亡中的作用可能与新兴的联合免疫疗法结合起来有用。
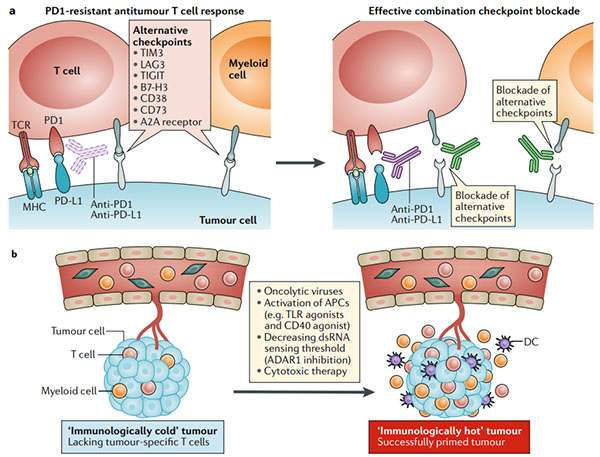
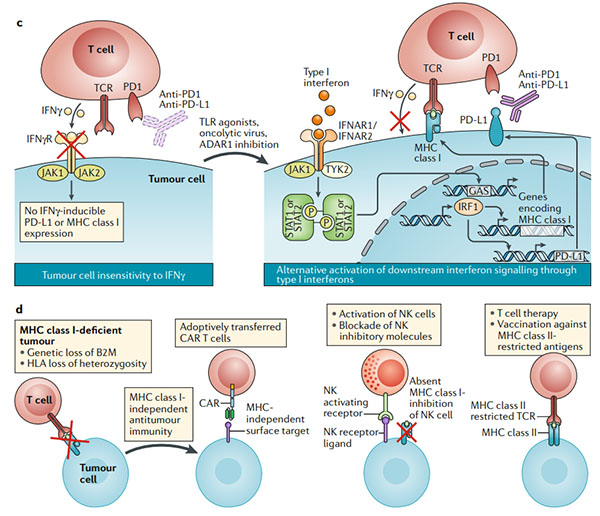
图4.克服肿瘤对免疫检查点阻断的内在抗性
a.程序性细胞死亡1(PD1)PD1配体1(PD-L1)轴可能不是抗肿瘤T细胞反应的唯一负调节剂。在肿瘤细胞或肿瘤微环境中的髓样细胞上表达的其他免疫检查点分子会阻止有效的抗肿瘤免疫力;组合的免疫检查点阻断可能会破坏这种耐药机制(右图)。
b.免疫学上较冷的肿瘤类型缺乏预先存在的抗肿瘤T细胞反应,使免疫检查点阻断无效。通过引起免疫原性细胞死亡(溶瘤病毒或细胞毒性疗法),引发抗原呈递细胞(APC;使用Toll样受体(TLR)激动剂和CD40激动剂)或增加肿瘤细胞对双链RNA敏感性来引发针对肿瘤的免疫系统的方法(dsRNA;例如对dsRNA特异性腺苷脱氨酶(ADAR1)的抑制作用)可以将免疫寒冷状态重新编程为检查点阻断反应状态。
c.没有干扰素-γ(IFNγ)信号传导的肿瘤缺乏响应IFNγ自适应表达PD-L1的能力。在一些MHC I类抗原呈递主要依赖于IFNγ信号传导的肿瘤中,IFNγ信号传导的丧失等同于抗原呈递的丧失。通过TLR激动剂,溶瘤病毒或其他方式激活其他干扰素途径(I型干扰素)也可能导致信号转导子和转录激活因子1(STAT1)和STAT2信号激活,从而激活PD-L1和MHC的转录通过干扰素调节因子1(IRF1)的诱导达到I类。
d.其他肿瘤通过基因改变(例如,β2-微球蛋白(B2M)的丧失和HLA杂合性的丧失)丧失了I类MHC表达后,对免疫检查点阻断具有抵抗力。在这种情况下,三种方法可以成功:(1)嵌合抗原受体(CAR)T细胞独立于MHC I类表达识别其靶标;(2)过继转移自然杀伤(NK)细胞或用细胞因子(例如IL-2或IL-15)刺激NK细胞,因为这些靶细胞缺乏MHC I类表达;(3)接种疫苗或过继性T细胞疗法产生针对特定MHC II类限制性抗原的反应。B2M,β2-微球蛋白;DC,树突状细胞;GAS,IFNγ激活位点;IFNAR1,干扰素-α和β受体亚基1;IFNγR,IFNγ受体;JAK1,Janus激酶1;TCR,T细胞受体。
化学疗法和放射疗法都可以通过多种提议的机制诱导免疫原性细胞死亡,这些机制在其他地方有详细介绍。在小鼠模型中,化学疗法和放射疗法的免疫效果均依赖于T细胞,并且两者均可 增强免疫检查站阻断的影响。然而,化学疗法和放射疗法具有充分证明的免疫抑制功能,可诱导对免疫疗法产生耐药性的肿瘤外源性机制。因此,这些标准疗法不太可能作为克服对免疫检查点阻断的内在抗性的主要方法出现,但是它们在控制疾病负担和引发免疫原性细胞死亡中的作用可能与新兴的联合免疫疗法结合起来有用。
溶瘤病毒具有感染肿瘤细胞并诱导细胞死亡的独特能力。为了治疗目的,它们也经常被基因改造以增强抗肿瘤免疫反应。基于单纯性1型疱疹病毒的Talimogene laherparepvec(或T-VEC,以Imlygic形式销售)是第一种获得美国食品药品监督管理局批准的溶瘤病毒。它在转移性黑色素瘤患者体内肿瘤内传递,在肿瘤细胞内优先复制并表达细胞因子GM-CSF以促进附近APC的成熟和激活。T-VEC被设计为不干扰被感染细胞中的抗原呈递,这与其衍生的病毒载体不同。结合抗PD1治疗,在转移性黑色素瘤患者的Ib期研究中,T-VEC的客观缓解率达到62%,比单独抗PD1治疗的预期缓解率更高。最值得注意的是,13例CD8 + T细胞浸润低的患者中有9例具有客观反应,而5例基线IFNγ产生低的患者中有3例具有完全反应,支持了T-VEC在没有预先存在的抗肿瘤免疫反应的患者中的作用。提出的机制如下:虽然病毒介导的免疫原性细胞死亡导致肽抗原的可用性,但病毒抗原的先天传感器促进IFNγ信号传导。这与T-VEC强制表达GM CSF一起,导致在肿瘤微环境中募集和激活APC。然后,APC在肿瘤微环境或引流淋巴结中引发或激活肿瘤特异性T细胞,从而逆转了由肿瘤建立的先前存在的免疫排斥。
增强肿瘤免疫原性的非基于病毒的肿瘤定向方法包括模式识别受体的激活剂,例如SD-101,这是一种具有CpG基序的合成寡核苷酸,可激活肿瘤微环境内肿瘤和非肿瘤细胞上的TLR9信号传导。在Ib期研究中,先前未接受过抗PD-1治疗的78%黑色素瘤患者具有客观反应。在多个小鼠模型中的临床前研究支持使用TLR9激动剂CpG寡核苷酸诱导全身性抗肿瘤免疫。这些包括SD-101和OX40激动剂抗体的组合,在多种模型中有效,包括转移性乳腺癌的自发小鼠模型。由于I型干扰素信号传导的遗传或表观遗传缺陷,固有免疫传感器的激动剂(可能是I型干扰素信号传导的强效诱导剂)也可以为肿瘤中的抗原呈递提供刺激,而这些抗原可抵抗免疫检查点阻断。
肿瘤细胞对免疫检查点阻断的敏感性可以通过其对内源性先天免疫信号(例如内源性dsRNA)的内在敏感性进行微调。将肿瘤细胞的设定点更改为内源性dsRNA(即降低dsRNA阈值)可能是克服肿瘤对免疫检查点阻断的内在抗性的途径。在针对小鼠黑素瘤细胞中2300多个基因的体内CRISPR筛选中,对抗PD1和GVAX13的反应更好的肿瘤中,ADAR1的丢失增加了,ADAR1编码一种将腺苷转化为肌苷的RNA编辑酶。B16小鼠黑素瘤中ADAR1的缺失逆转了肿瘤微环境的免疫寒冷状态,并增加了肿瘤细胞对I型或II型干扰素直接抗肿瘤作用的敏感性142。在ADAR1缺陷型肿瘤中对抗PD1治疗的改善反应取决于两个dsRNA传感器MDA5和PKR中至少一个的存在。这些数据支持了肿瘤内在RNA感应在免疫检查点阻断功效中的作用。然而,仍在研究肿瘤固有的细胞质DNA的作用。
宿主先天免疫感应在免疫检查点反应中起着众所周知的作用,但在适当条件下可能是必需的。胰腺导管腺癌的T细胞浸润最少,对免疫检查点阻滞的反应较差。在胰腺癌小鼠模型中,化学疗法,共刺激蛋白CD40的激动剂和抗PD1疗法的组合可产生T细胞依赖性抗肿瘤功效。CD40在包括树突状细胞在内的免疫细胞中广泛表达,已知其与CD40配体的结合可许可抗原呈递。结合化学疗法和抗PD1治疗,CD40激活和化学疗法诱导的免疫原性细胞死亡以BATF3 +树突状细胞依赖性方式驱动T细胞活化,但独立于宿主先天性免疫信号传导途径,包括通过MYD88,TLR4, TRIF,TLR3,STING,P2X74,caspase 1和caspase11。CD40激动剂联合化学疗法和抗PD1疗法的I / II期研究正在进行中(NCT03214250)。
对于携带遗传缺陷会损害MHC I类或II类抗原呈递的肿瘤的患者,正在研究至少两种基于免疫的方法(图4d)。基于嵌合抗原受体(CAR)的过继T细胞疗法是一种针对血液系统恶性肿瘤的有效免疫疗法,由于它直接靶向肿瘤细胞表达的特定表面分子,因此无需通过MHC提呈抗原。然而,由于缺乏肿瘤特异性表面抗原和免疫抑制性微环境,因此对于CAR T细胞而言,成功治疗实体瘤一直是遥不可及的。新颖的工程方法可创建双重靶标活化的CAR T细胞,具有合成AND门逻辑开关以提高安全性和靶标特异性的CAR T细胞以及对肿瘤微环境中的免疫抑制信号不敏感或协同选择的CAR T细胞(例如转化生长因子-β信号转导)有望为该方法提供前景。针对MHC缺乏型肿瘤的另一种方法是使用自然杀伤(NK)细胞进行细胞疗法,以消除缺乏MHC I类分子的细胞。缺乏对ADAR的B2M缺陷型B16肿瘤,对GVAX和抗PD1疗法的联合治疗敏感,被发现会增加NK细胞的浸润。NK细胞疗法的研究已经进行了数年的研究,最近,NKG2A的阻滞在NK和T细胞上均表达,这是一种基于酪氨酸的抑制性基序,已被证实在头颈部鳞状细胞癌患者中具有活性。
最后,为了解决由致癌信号驱动的免疫检查点阻断抗性的机制(图5a),研究人员将致癌信号通路的现有抑制剂重新定位为增强抗肿瘤免疫力的一种方法(特别是与免疫检查点阻断结合使用)。这些包括WNT信号抑制剂,CDK4和CDK6抑制剂以及MAPK和PI3K抑制剂(如图5b所示)。
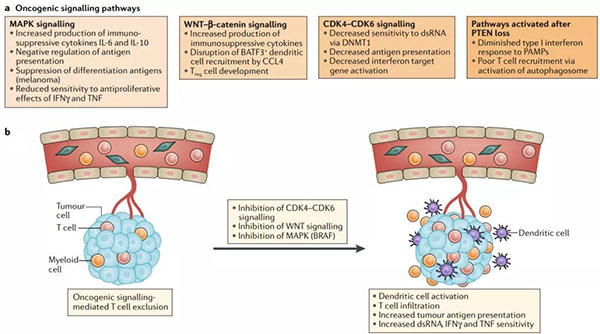
图5.影响抗肿瘤免疫力和免疫检查点阻滞性的致癌信号通路
a.致癌信号通路提供了独特的免疫逃逸的肿瘤内在机制。在这里,我们重点介绍了与抗肿瘤免疫有关的四个关键致癌信号通路:有丝分裂原活化蛋白激酶(MAPK)信号通路,WNTβ-连环蛋白通路,细胞周期蛋白依赖性激酶4(CDK4)CDK6细胞周期信号通路和激活的 磷酸肌醇磷酸酶PTEN丢失的结果。
b.CDK4 CDK6信号传导(例如使用palbociclib或abemaciclib),MAKP信号传导(BRAF抑制剂)或WNT信号的治疗性破坏可逆转肿瘤固有T细胞的排除状态,并恢复对免疫检查点阻断的敏感性。BATF3,基本的亮氨酸拉链转录因子ATF样3;CCL4,CC趋化因子配体4;DNMT1,DNA(cytosine-5)-methyltransferase 1; dsRNA,双链RNA;IFNγ,干扰素-γ;PAMPs,病原体相关分子模式;TNF,肿瘤坏死因子;Treg细胞,调节性T细胞。
Conclusion
识别对免疫检查点阻滞的抗性机制的过程已经重新发现了调节抗肿瘤免疫的主要机制。肿瘤对免疫检查点阻断的敏感性由肿瘤生物学决定:具有共同的组织学、分子和遗传特征的肿瘤患者对免疫检查点阻断的反应率相似。肿瘤内源性因子通过其对肿瘤与宿主免疫系统之间相互作用的影响,可以间接在抗肿瘤外源性机制中发挥作用。但是,本综述的重点放在直接受肿瘤内在因素影响的耐药机制上。由于增加了突变负荷和抗原性,激活了从头抗肿瘤免疫反应的肿瘤最有可能受益于免疫检查点的阻断。但是,即使具有足够的抗原性,IFNγ信号传导和抗原呈递中的肿瘤固有遗传缺陷也会破坏对免疫检查点阻断的敏感性。致癌信号通路通过指示募集对于启动和影响抗肿瘤免疫应答至关重要的细胞,影响IFNγ和抗原呈递通路,或者通过在肿瘤微环境中诱导免疫抑制因子,也是免疫检查点阻断抗性的介质。绕过IFNγ信号传导和抗原呈递缺陷或抑制免疫抑制致癌信号通路的靶向方法有望扩大免疫检查点阻断的影响。
如涉及知识产权请与我司联系
文献来源:
Kalbasi A, Ribas A. Tumour-intrinsic resistance to immune checkpoint blockade. Nat Rev Immunol. 2020;20(1):25–39. doi:10.1038/s41577-019-0218-4
|