时迈药业宣布,近日在浙江大学医学院附属第一医院启动的CMD011开放性、多中心临床试验中,首例受试者已入组接受治疗。本研究旨在评估CMD011在晚期肝细胞癌患者中安全性、耐受性、药代动力学特征和有效性,并确定CMD011的扩展阶段推荐剂量。
CMD011是时迈药业基于自主开发的抗体筛选文库和完全自主知识产权的双抗平台构建的肿瘤细胞靶点+免疫细胞靶点组合的全人源抗GPC3×CD3双特异性抗体。CMD011通过共结合GPC3阳性肿瘤细胞和CD3阳性T细胞诱导T细胞活化并杀伤肿瘤细胞。GPC3高度特异表达于肝细胞癌中,最大程度地提高肿瘤选择性,大幅拓展治疗窗口,降低毒副作用。 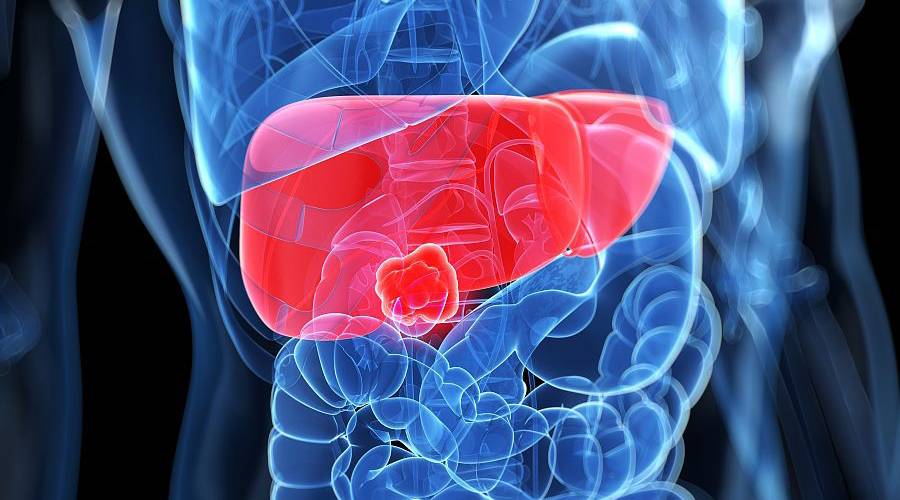
肝癌对化疗、靶向治疗、免疫治疗等的多种抗肿瘤治疗不敏感,其五年生存率远低于所有类型肿瘤的平均生存率,一旦进展或复发后治疗选择极其有限,终末期患者仅有支持性治疗,临床上存在较大未满足需求。本研究致力于发掘CMD011的肝癌治疗潜力、定位可能的获益人群,为肝癌患者提供全新的、可及的治疗选择,并有望改变目前肝癌临床治疗现状。 本研究由浙江大学医学院附属第一医院党委书记、肝胆胰外科主任医师梁廷波教授牵头,研究团队章琦主任表示:“非常高兴我们团队完成了CMD011研究的首例受试者入组与给药,希望CMD011有潜力为肝癌患者提供全新的治疗选择。” 时迈药业CEO孝作祥博士表示:“时迈药业自成立以来,以自主知识产权的双抗平台HBiTE为依托,以解决临床未满足需求为己任。我们相信通过多方合作,技术创新,将更好挖掘平台潜力。目前,时迈药业已有多款抗体候选药物进入临床研究阶段。我们期待与合作伙伴携手,以最安全和科学的方式全力推进研究进展,早日看到抗体药物应用于肿瘤临床治疗,为更多患者服务。” |