近期“生物世界”的一篇原创文章,介绍了Cell在今年2月15日发布的“Inhibitory CD161 receptor identified in glioma-infiltrating T cells by single-cell analysis”(图1)。这篇论文的高光之处在于,单细胞在组织内成像的技术,实现了单细胞级别的蛋白表达检测。并且,文中提出了类似于免疫治疗的思路,将CD161视为潜在的治疗靶点,阻断CD161以激活细胞毒性T细胞(图2)。 图1 Cell最近发布的关于CD161的文章。高光之一:高技术,单细胞级别检测CD161在T细胞的表达,这些T细胞渗透进入了神经胶质瘤组织。 图2 高光之二:证明机制,具有细胞毒性的T细胞,也表达多种NK细胞受体。其中NK细胞表达的抑制型受体CD161,在T细胞也有表达,通过结合免疫调节细胞表达的CLEC2D,体现抑制活性。通过阻断CD161与CLEC2D的结合,可以激活T细胞的活性。
一、给你一张过去的CD CD161,别名NKRP1A(NK受体P1A)、KLRB1、CLEC5D,以下均称为CD161。其中,KLRB1(killer cell lectin-like receptor subfamily B1)是推荐的名称,中文翻译为“杀伤细胞的类凝集素受体亚家族B成员1号”。CD161目前只发现一种序列,没有其他变体。 LLT1,别名CLEC2D(前言的Cell所称),以下均称为LLT1,作为CD161的配体。LLT1(lectin-like transcript 1)为CLEC2D的1号变体,中文翻译“类凝集素转录体1”。这意味着CLEC2D存在多个变体,其中只有变体1,即LLT1,具有结合CD161的能力,且能够激活下游信号。其他变体,比如变体2、4,不结合CD161。 CLEC,C-type lectin domain family,可见CD161和LLT1同属于这个大家族,分属不同的亚家族。 CD161和LLT1的表达 CD161主要表达于粒细胞,以及单个核细胞的表面(图3A),表达特异性较好。单个核细胞,包括NK细胞和T细胞,其中T细胞包括Th17、NK T、记忆T细胞,但不包括原始T细胞(图3B)。另外,IL-17的表达与CD161的表达有极大的相关性,比如CD4+ TCRαβ+、CD8+ TCRαβ+、CD4-CD8- TCRαβ+、CD4-CD8-TCRγδ+等产生IL-17的细胞,它们存在CD161表达。另外,CD161+的细胞,IL-23R和RORC的表达量显著高于CD161-的细胞。 LLT1主要表达在小肠的派尔淋巴结,以及粒细胞、淋巴细胞(包括B细胞、T细胞、NK细胞)、扁桃体、肺、肾上腺、肾等部位(图3C)。外周循环的B细胞、T细胞、NK细胞、单核细胞、树突状细胞,在静息状态下,不表达LLT1,但是激活后,比如TLR(toll-like receptor)激活的类浆细胞、单核细胞衍生的树突状细胞、激活的B细胞,都一定程度地表达LLT1,对NK细胞有抑制作用,但对T细胞具有激活作用。 图3A,CD161在粒细胞和单个核细胞中高表达,主要在淋巴组织表达,摘自bgee.org。 图3B,CD161的表达情况,分别在患者的上皮组织内淋巴细胞(灰)、肝淋巴细胞(白)、外周血淋巴细胞,分别是大约75%、60%、20%。其中,上皮组织内的CD3+CD161+阳性的天然T细胞,显著高于CD3-CD161+的NK细胞。 图3B,LLT1在小肠的派尔淋巴结高表达,主要在淋巴节和粒细胞表达,摘自bgee.org。 CD161和LLT1的信号通路 CD161在NK细胞上,作为抑制型受体,通过与其配体LLT1(CLEC2D)的结合,抑制NK细胞的细胞毒性,抑制IFN-γ的释放(图4A)。也有研究表明,在T细胞上,尤其是Th17上,CD161可作为其细胞亚群标记,为激活型受体,激活Th17表达和分泌IL-17(图4B)。也可以通过TCR信号通路激活T细胞,促进IFN-γ的释放。 图4A,NK细胞机制。LLT1表达在特殊的肿瘤组织中,比如三阴性乳腺癌(TNBC)、前列腺癌、B细胞非霍奇金淋巴瘤细胞。表达于肿瘤细胞表面的LLT1,与NK细胞表达的CD161结合,给出抑制信号,降低其细胞毒性。LLT1在部分肿瘤组织中高表达,以抑制NK细胞的杀伤。 图4B,T细胞机制。神经磷脂酶(ASM),调节CD39和CD161的细胞内信号,并促使Th17的增殖。在Th17分化条件下,CD4+ T细胞内,MHC/CD3/CD28,以及IL-6的刺激信号,激活mTOR和STAT3信号。同时,CD39和CD161的刺激信号进一步增强了上述信号,最终导致Th17增殖,以及分泌IL-17。 CD161的胞内区并没有NK细胞受体常见结构域的ITIM,即“免疫受体中基于酪氨酸的抑制型模体”,或ITAM,激活性模体。因此,CD161激活后的下游信号,不同于常见的NK细胞受体激活模式,并且在NK、T细胞中可能产生了不同的结果:一方面,胞内域通过与CD39的结合,激活神经磷脂酶(ASM、SMPD1),通过STAT3、mTOR等通路,上调细胞内神经酰胺的表达;另一方面,激活AKT1/PKB和RPS6KA1/RSK1激酶和下游信号,这与通过CD3激活T细胞的通路一致。 研究表明,CD161的表达,受IL-12调控,依赖于IL-12作用时间和剂量。IL-12可提高NK细胞表面的CD161,进而抑制NK细胞活性,这是一个负反馈的过程。另一方面,IFN-β可导致CD161表达降低。 CD161和LLT1的结构和修饰 CD161是一种二型的穿膜糖蛋白,存在3对链内二硫键,以及1个N糖基化位点(图5)。 LLT1也是一种二型的穿膜糖蛋白,存在2对链内二硫键,以及2个N糖基化位点(图5)。 二型的穿膜蛋白,即N端为胞内域,C端为胞外域。 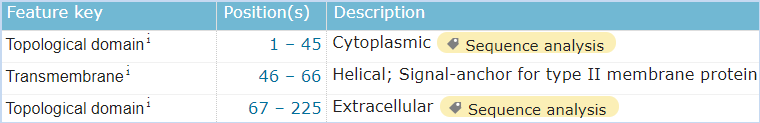
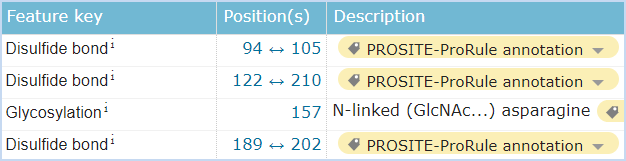 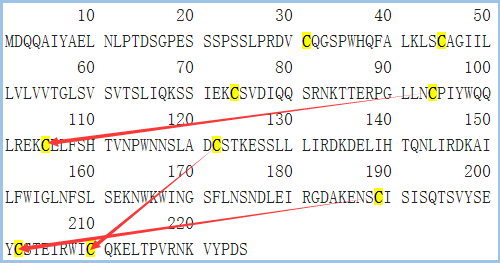
图5 CD161的结构信息,摘自Uniprot.org。CD161全长为225个氨基酸,保外域为67~225,其中含有3对链内二硫键,并存在1个N糖基化位点。 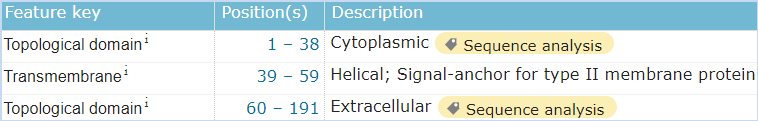
 
图6 LLT1的结构信息,摘自Uniprot.org。LLT1全长为191个氨基酸,保外域为103~184,其中含有2对链内二硫键,并存在2个N糖基化位点。 考虑到如果我们筛选一种阻断CD161-LLT1结合的抗体,N糖基化如果影响了表位的构象,那么抗体的结合也会受到N糖基化的影响。如果付诸于行动,这个修饰的问题是无法绕开的。
二、迷失自我的狂欢 从CD161在NK细胞上的调控模式看,存在顺式作用(NK细胞能在某种刺激条件下,同时表达CD161和LLT1,抑制自身活性)、反式作用(B细胞、T细胞、树突状细胞表达LLT1,从而抑制NK细胞)。阻断CD161-LLT1的结合,可以增强NK细胞的细胞毒性,释放IFN-γ。 另一方面,CD161+CD8+的T细胞,被分类为组织追踪MAIT(粘膜相关不变T细胞),细胞毒性Tc17细胞,或者记忆T细胞,具有组织追踪和增强的细胞毒性。记忆细胞可以对病毒感染、细菌感染、抗原呈递细胞的刺激做出响应,进而上调细胞因子,比如INF-γ、IL-17,释放颗粒酶。 利用NK细胞的免疫检查点机制,对NK细胞的抑制解除,以及激活,是一种新的免疫治疗的前沿。我在之前的文章(https://mp.weixin.qq.com/s/5bWB41CAyKXi0348XTtIHw),总结了NK细胞作为免疫治疗的新方向,列举了一些NK细胞的激活或抑制型受体。比如激活型的KIR2DS、NKp80、NKp46/44/30、NKG2C/D/E、DNAM-1、CD16a,抑制型的KIR3DL、NKG2A/CD94、CD161/LLT1、PD-1、TIGIT、CD96、LAG3等(图7、8)。 图7 NK细胞表面的抑制型受体(红)和激活型受体(绿)。ITIM,immuno-receptor tyrosine-based inhibitory motifs,免疫受体中基于酪氨酸的抑制型模体;ITAM,immuno-receptor tyrosine-based activation motifs,免疫受体中基于酪氨酸的激活型模体。KIR,killer Ig-like receptor,杀手细胞类免疫球蛋白受体。 图8 NK细胞受体的分类。在NK细胞上,顺式结合的CD161和LLT1,与MHC-I结合,抑制其活性。 NK细胞,占PBMC的5~10%,与CD8+ T细胞,有类似的杀伤活性(cytotoxicity),但是细胞的标记物与CD8+ T细胞有显著差异,不表达CD3和TCR。NK细胞的抗原特征为CD56+CD3-,其中85%~95%的NK细胞为CD56dim(暗)CD16ahigh,主要是成熟的杀伤细胞,高表达KIR,可分泌穿孔素和颗粒酶,剩余的为CD56bright(亮)CD16alow,有未成熟的NK细胞,低表达KIR和NKG2A/CD94。NK细胞的分类中,还包括抗原呈递NK(APNK)、辅助NK(NKh)、调节NK(NKreg)。 与T细胞需要抗原呈递的过程不同,细胞毒性NK细胞是天然免疫系统的一部分,不需要抗原呈递,组织相容性复合体(MHC)I类复合体与NK细胞结合,通常激活抑制型的受体(含ITIM,图7),抑制了NK细胞的活性,这也是组织细胞避免被NK细胞杀伤的机制。在一部分肿瘤组织中,肿瘤细胞虽然下调了MHC-I的表达,规避了T细胞的识别,但因为MHC下调激活了NK细胞的活性,补充了T细胞的不足。 NK细胞的杀伤机制,称为“missing self”,即“迷失自我”。也有研究表明,MHC-I可激活NK细胞(图8)。因此,NK细胞的杀伤活性,基于抑制和激活信号的平衡。 因此,如果不考虑肿瘤内环境的恶劣、肿瘤细胞对NK细胞的塑造、调节型细胞的抑制的话,类比NKG2A/CD94,我们也可以将CD161/LLT1加入到这一场NK细胞“迷失自我的狂欢”中。目前,关于NK细胞的抗体(BiKE、TriKE),或者CAR-NK的临床实验,也在如火如荼进行中,也可以给我们一些借鉴。 然而,我们不能过于乐观地估计NK细胞的杀伤,除了血液淋巴瘤,还有肿瘤微环境的巨大挑战: 1. 抑制信号,包括抑制型受体介导的(图7、8),以及抑制型细胞因子,比如TGFβ、IL-10; 2. 抑制细胞,Treg、NKreg、骨髓瘤衍生抑制型细胞(MDSC)、基质细胞、成纤维细胞、肿瘤细胞;比如,Treg细胞、MDSC细胞表达TGFβ,结合NK细胞的TGFR2,从而下调其表面的NKG2D、NKp30这些激活型受体,使其被激活的能力降低; 3. 浸润能力,在非小细胞肺癌(NSCLC)中,未检测到NK细胞亚群,但是存在CD161+CD4+、CD161+CD8+的T细胞。在结直肠癌中,几乎完全排除NK细胞的浸润; 4. 肿瘤微环境中,缺氧、低糖,颗粒酶B的半衰期显著降低。 我们可以通过IL-12、IL-15、IL-18,是NK细胞聚集在肿瘤组织并维持活性。然而,IL-12促进CD161的表达,进而抑制NK细胞的活性。IL-15具有促进NK细胞增殖和杀伤活性的能力,但是单独使用,并不能维持NK细胞的渗透能力。
三、小结 本期推送,我们给大家介绍了CD161和LLT1,并且讲述了CD161在NK细胞上的调控模式以及肿瘤微环境的巨大挑战。下一期中,我们会接着带来CD161成药性的挑战以及CD161在T细胞尤其是CD8+的T细胞的病理机制。 |